Teoría del Intercambio Gaseoso y del Umbral de Acidosis Láctica (Umbral Anaeróbico)
Karlman Wasserman, Brian J Whipp y William L Beaver
Artículo publicado en el journal PubliCE, Volumen 0 del año 1990.
Publicado 14 de julio de 2006
Resumen
Palabras clave: umbral del lactato, amortiguador, pH, acidosis metabólica, ácido láctico
INTRODUCCION
En 1930, Harrison y Pilcher (1) observaron marcadas diferencias en el intercambio gaseoso durante el ejercicio en pacientes con fallas cardíacas, en comparación con sujetos normales que realizaban la misma tasa de esfuerzo. Estas diferencias incluían una mayor deuda de O2 y producción de CO2 (VCO2) en los pacientes cardíacos. Ellos atribuyeron esto último al bicarbonato (HCO3-), que actuó como sustancia buffer de la acidosis metabólica desarrollada por los pacientes, a relativamente bajos esfuerzos (2). Desde ese momento, se ha confirmado en forma repetida que los pacientes con enfermedades cardíacas desarrollan una acidosis metabólica (láctica), con esfuerzos considerablemente menores que los sujetos normales (3-9). Hill y cols. (10), en 1924, observaron que la deuda de O2 durante un ejercicio estaba relacionada con el lactato acumulado. Al mismo tiempo, Barr y Himwich (11) mostraron que el lactato sanguíneo no cambiaba con tasas de esfuerzos bajas o moderadas, pero que aumentaba marcadamente con esfuerzos intensos. Además mostraron que el HCO3- actuaba como sustancia buffer de casi la totalidad del ácido láctico acumulado. Bock y cols. (12) confirmaron, en estudios siguientes, que el balance ácido-base sanguíneo durante el ejercicio, no cambiaba con tasas metabólicas bajas y moderadas en comparación con el reposo, pero que se desarrollaba una acidosis metabólica en forma abrupta cuando la tasa de esfuerzo se incrementaba a niveles más altos. En 1930, Owles (13) reportó similares resultados sobre los cambios de lactato en sangre y HCO3- en dos sujetos normales que realizaban ejercicio a diferentes intensidades. Estos hallazgos apoyan el concepto de que el incremento del lactato durante el ejercicio, no es una función continua monotónica de la tasa de esfuerzo. A partir de estos estudios sobre la regulación del ácido-base durante el ejercicio, numerosos investigadores han confirmado que la única perturbación de ácido-base que sistemáticamente se desarrolla durante el ejercicio intenso es la acidosis metabólica (14-17), y esto puede ser atribuido, casi con exclusividad, al aumento del lactato formado durante un esfuerzo elevado; aunque también se ha observado ocasionalmente, una pequeña acidosis respiratoria (18) y alcalosis (con trabajos suaves) (19). Otros estudios han mostrado que el lactato no se incrementa en la sangre con esfuerzos bajos o moderados, sugiriendo que existe una tasa de trabajo o umbral metabólico, por sobre la cual se aumenta la concentración láctica (11, 13, 20, 21). Este aumento en el umbral de lactato está influido por el nivel de aptitud física, estado de entrenamiento (3, 22-24) y por el contenido de O2 en la sangre (25-34). Wasserman y McIlroy (35) denominaron “umbral anaeróbico” (UA) a este umbral de incremento del lactato sanguíneo, ya que las evidencias experimentales indicaban que esto ocurría a un consumo de O2 (VO2) por sobre el cual el metabolismo anaeróbico suplementaba al metabolismo aeróbico. Se realizaron intentos de desarrollar métodos de monitoreo del intercambio gaseoso a través de mediciones “ventilación a ventilación” (21, 35-37), con la creencia de que tales técnicas serían útiles para detectar, en forma no invasiva, el UA, ya que: 1) el lactato producido tiene un ion de hidrógeno (H+); y 2) el CO2 sería liberado del bicarbonato, a medida de que éste actuaba como buffer del ácido láctico, esto es, a través de la reacción química:
H+La- + Na+HCO3- → Na+La- + H2CO3 → CO2 + H2O
Con el avance de nuevos analizadores de gases y con la introducción de computadoras para el cálculo del intercambio gaseoso durante cada ventilación, se facilitó en gran medida el objetivo original. Hoy en día, el VO2 en el UA durante un test de esfuerzo progresivo puede ser determinado en una forma confiable y no invasiva, utilizando un método de intercambio gaseoso que es dependiente de la capacidad buffer del ácido láctico por el bicarbonato y es relativamente dependiente de la respuesta ventilatoria al ejercicio (37). Los esfuerzos superiores al umbral anaeróbico, están asociados con un aumento sostenido de la producción lactato/piruvato (L/P), y este incremento es considerado como una manifestación del cambio en el potencial redox de la célula, consecuente con un inadecuado aporte de O2 a la mitocondria (38-40), durante estos niveles de ejercicio. Debido a que el incremento de lactato está acompañado por un aumento de H+, la acidosis metabólica es la resultante de tasa de esfuerzo superiores a aquellas a las cuales el lactato muscular comienza a aumentar (Figura 1). Por lo tanto, el UA puede ser considerado como el parámetro que representa el nivel más alto de VO2 que una persona puede mantener sin desarrollar una acidosis láctica sostenida. En personas normales este hecho ocurre, aproximadamente, el 55% de su VO2 máx. predeterminado. Las bases conceptuales de la medición no invasiva del UA a través del intercambio gaseoso son que: 1) existe un nivel de transición del VO2 en el cual el estado redox de las fibras contráctiles se reduce, lo que resulta en mayor transformación del piruvato a lactato y en el incremento de la proporción L/P (ver texto de la Figura 1); esto es, que los cambios del potencial redox y del lactato tienen una dinámica de umbral con respecto al VO2, durante el ejercicio; 2) estos cambios en el potencial redox celular son consistentes con el concepto de que hay un rango en la tasa de esfuerzo, para el cual el aporte de O2 no satisface completamente los requerimientos mitocondriales de los músculos que se contraen, lo que debe ser distinguido de aquel rango de esfuerzo para el cual el aporte de oxígeno es adecuado (Katz y Sahlin (40), aportaron evidencias sobre los mecanismos dependientes del O2 en el incremento del lactato durante el ejercicio); 3) debido a que el H+ producido con el lactato es inmediatamente tamponado en la célula muscular, hay una liberación de 22,4 ml de CO2 por cada meq de ácido láctico tamponado por HCO3-. Esta producción extra de CO2 del tamponamiento (acción buffer de bicarbonato) es discernible por el análisis de intercambio gaseoso. Algunos autores (41-45) han cuestionado la validación del concepto de UA. Estos cuestionamientos han variado, y se pueden resumir en: 1) ¿Obedece verdaderamente la concentración de lactato sanguíneo a la dinámica de umbral, durante un test donde el esfuerzo aumenta progresivamente?; 2) ¿Afecta el incremento de lactato el intercambio gaseoso?; 3) Debido a que las mitocondrias pueden funcionar con un PO2 tan bajo como 1 mmHg (46), ¿cómo pueden las mismas transformarse en anaeróbicas durante el ejercicio?; 4) debido a que el entrenamiento reduce la producción de lactato sin un incremento en el flujo sanguíneo muscular (47), ¿cómo puede el aumento de lactato ser dependiente del flujo sanguíneo, a tasas de esfuerzo submáximas?; y 5) ¿El incremento de lactato ante el aumento de las intensidades de esfuerzo ocurre debido a un cambio en el tipo de fibras oxidativas a glucolíticas? (48). Wasserman (49) y Katz y Sahlin (40) han respondido en forma sistemática estos cuestionamientos. Nosotros creemos que el peso de las evidencias apoya las siguientes conclusiones: 1) el aumento de lactato durante el test de ejercicio progresivo tiene una dinámica de umbral, y este umbral es independiente del aumento de piruvato; 2) el patrón del intercambio gaseoso está altamente influido por la acumulación de lactato durante el ejercicio; y 3) el transporte de O2 a las mitocondrias de los músculos que realizan ejercicio puede llegar a ser un factor limitante crítico.
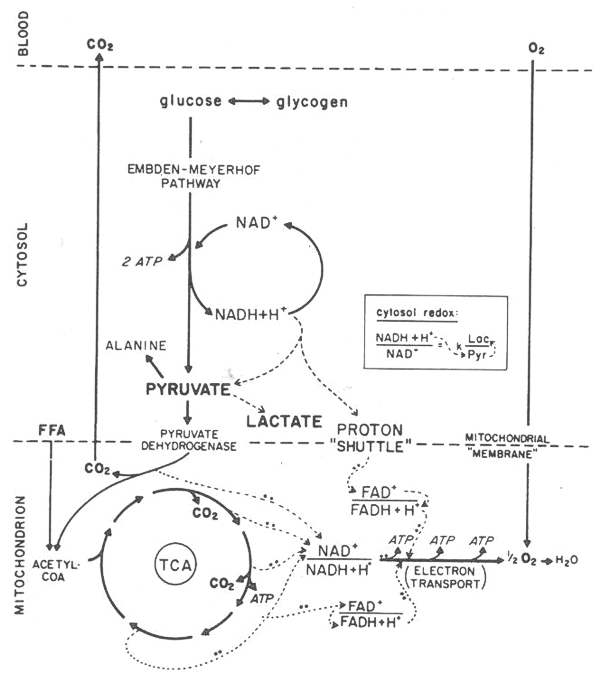
Figura 1. Diagrama de los caminos metabólicos para la producción de
fosfatos de alta energía (ATP). Cuando el aporte de O2 a la mitocondria es
suficiente, el NADH es reoxidado a través del transporte de protones en la
membrana mitocondrial. Cuando este aporte es inadecuado, el piruvato reoxida al
NADH, resultando en acumulación de lactato y en cambios del potencial redox del
citoplasma. (reimpreso de Wasserman K, Hansen JE, Sue DY, Whipp BJ: Principles
of Exercise Testing and Interpretation. Philadelphia, Lea & Febiger, 1987, p. 5)
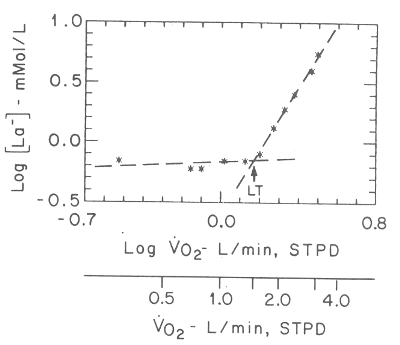
Figura 2. Gráfico LOG-LOG (conversión logarítmica de los valores de las
variables de la abcisa y la ordenada) de la concentración de lactato arterial
vs. VO2 en un sujeto. Las dos líneas de guión representan líneas de regresión
que ajustan valores de lactato en nivel constante o con incrementos muy leves de
lactato debajo del umbral lactácido (LT), y con aumentos del lactato por sobre
el umbral. El punto de intersección de las líneas estima la ubicación del umbral
anaeróbico (LT), que es el punto a partir del cual el lactato comienza a
acumularse más rápidamente. El VO2 también se muestra en unidades convencionales
(Reimpreso con permiso de Beaver WL, Wasserman K, Whipp BJ: Improved detection
of lactate threshold during exercise using a log-log transformation. J Appl
Physiol 1985; 59: 1936-1940).
DINAMICA DE UMBRAL DEL LACTATO ARTERIAL Y DEL COCIENTE LACTATO/PIRUVATO
La pregunta respecto a si el lactato sanguíneo aumenta como una función continua de la tasa metabólica durante un esfuerzo en aumento, o si sólo comienza a incrementarse sistemáticamente pos sobre un umbral metabólico particular, es fundamental para entender los mecanismos energéticos del ejercicio. Desde 1920, un gran número de investigadores sostuvieron que el lactato sanguíneo no aumentaba significativamente con tasas de esfuerzo bajas y moderadas (3, 11, 13, 20-24, 31-33), y en trabajos subsiguientes se ha apoyado el concepto de que los perfiles del lactato arterial (50-52) y muscular (53-56) exhiben características de umbral. Sin embargo, 1983, Yeh y cols. (57) observaron que el lactato se incrementaba exponencialmente en función del aumento del VO2 (sin observarse un umbral), debido a que sus datos se ajustaban a una línea recta en un gráfico semilogarítmico. Sin embargo, su protocolo utilizó una muestra no uniforme, y se recogieron muy pocos datos durante las tasas de esfuerzo bajas; además, no intentaron determinar si sus datos se ajustaban mejor a un modelo de umbral que a uno continuo. Debido a las importantes implicancias fisiológicas de este estudio, Beaver y cols. (50) repitieron este estudio con una densidad uniforme en el muestreo arterial, y observaron que los datos se adecuaban a un modelo semi-logarítmico con dos componentes lineales bien definidos, los cuales tenían un punto de intersección, o sea, un umbral. El gráfico de dos componentes (por ej. un incremento muy pequeño o un incremento de lactato piruvato-no-dependiente a bajas intensidades, seguido de un aumento significativo del lactato y del cociente L/P) se adecua a los datos experimentales, 8 veces mejor que el modelo mono exponencial (por ej. no-umbral). Beaver y cols. (50) también observaron que los puntos cercanos al umbral se adaptaban mejor a un modelo de transformación log-log que a un modelo semi-log, como se exhibe en la Figura 2. Esto muestra que los puntos de datos se pueden dividir fácilmente en dos regiones distintivas, que pueden ser ajustadas por líneas rectas. Más recientemente, se volvieron a proponer argumentos en contra de la dinámica de umbral (44). Utilizando un modelo matemático mono exponencial para ajustar los datos del lactato versus el VO2, derivados de estudios de esfuerzos progresivos, Hughson y cols. (44) concluyeron que el lactato aumentaba en función continua del VO2, en contraste con el modelo de transformación log-log utilizado por Beaver y cols. (50). Estas conclusiones contradicen el concepto de que existe un umbral en el incremento de lactato y de la tasa L/P, así como se oponen a antiguas evidencias de que la concentración de lactato sanguíneo es igual en trabajos leves que en reposo. Si este modelo continuo fuera correcto, tendría importantes implicancias con respecto al cambio del potencial redox de las células musculares, en relación con la intensidad del esfuerzo. Sin embargo, este modelo está en conflicto con los patrones de cambio de la proporción L/P, con el pH muscular calculado a través de resonancia magnética nuclear (31, 58), y con los cambios en el lactato observados con biopsias musculares (53-56). Debido a que el estudio de Hughson y cols. (44) se basó en resultados que nos interesan discernimos por sus aspectos metodológicos y de interpretación, por lo menos en el aspecto en que fallan en considerar el patrón de cambio en el cociente L/P, es que sentimos la necesidad de reexaminar nuestro modelo de umbral, en relación con el modelo de Hughson, es decir exponencial continuo. Como mencionamos anteriormente, estudiamos 10 varones que gozaban de buena salud, entre 19 y 39 años de edad (50). Cada sujeto se sometió a un test de ejercicio progresivo en bicicleta ergométrica con incrementos en la tasa de esfuerzo de 15 W/min, hasta el límite de tolerancia; los tests fueron siempre precedidos por un período de 4 minutos de entrada en calor sin ninguna carga en la bicicleta. La ventilación minuto (VE), el VO2, y el VCO2 fueron computados ventilación por ventilación, utilizando una computadora en interfase Hewlett-Packard (modelo 1000, Hewlett-Packard, Palo Alto, California), como se mencionó anteriormente (59). Se recogieron muestras de sangre, a través de un catéter en la arteria braquial, durante el reposo, en el período de entrada en calor, y cada 2 minutos durante el período de ejercicio progresivo. Se analizaron estas muestras para determinar el lactato y piruvato, como se describió previamente (51), y el HCO3 fue calculado a través de mediciones del pH y de la PaCO2 utilizando la ecuación de Henderson-Hasselbalch. Los umbrales de lactato, HCO3 estándar, y la tasa L/P fueron determinados en la forma previamente reportada (50, 60).
Análisis de Datos
Realizamos un análisis comparativo de nuestros datos, similar al análisis de Hughson y cols. (44), para investigar si el modelo de umbral de los cambios en la concentración de lactato (50), brinda una mejor descripción del aumento en la concentración de lactato arterial ([La-]) que el modelo exponencial continuo (44). El modelo de umbral es derivado ubicando en el gráfico [La-] versus VO2, y ajustando los puntos con dos líneas de regresión (Figura 2) (50). Generalmente, la pendiente de la parte más baja de la línea es muy pequeña, en comparación con la pendiente de la parte más alta de la línea, que es muy pronunciada. Esto define claramente una transición en la tasa de acumulación de lactato. La intersección de las dos líneas define el umbral de lactato (o lactate threshold, LT). El modelo exponencial continuo (44) expresa a la [La-] en relación a la siguiente función del VO2:
[La-]= a + b.exp (c.VO2) (1)
En donde, a, b, y c son los parámetros del modelo. En el análisis, [La-] es graficada en contra de exp (c.VO2). Los puntos son ajustados por una regresión lineal, y c es ajustado para minimizar las desviaciones de las sumas de los cuadrados (SSDs) en [La-] entre los puntos de datos y la línea de regresión. La ecuación 1 representa el mejor ajuste de la concentración continua de lactato en función del incremento de VO2. Este modelo sostiene la teoría que el lactato aumenta en forma continua, sin un punto de ruptura que podría definir un umbral. Hughson y cols. (44) compararon el ajuste de los puntos de los datos de los dos modelos utilizando un análisis de las SSDs. Observaron que las SSDs del modelo continuo eran significativamente menores que las del modelo de umbral, y por lo tanto, concluyeron que el modelo continuo se adecuaba mejor y que no existía un umbral. Hughson y cols. (44) notaron, como nosotros, que la principal contribución del modelo de umbral a las SSDs era por un sistemático patrón de desviaciones hacia el límite superior del rango del VO2, más que por una aparente distribución aleatoria de errores. Pero, matemáticamente, la evaluación de modelos basada en las SSDs, es una comparación estadística que presume errores aleatorios, esto es, que las desviaciones del modelo de curva están distribuidas al azar, en cualquier parte, alrededor del modelo de curva. Tal análisis no debería ser aplicado sin juzgar la aleatoriedad de la distribución de las desviaciones. Sin las desviaciones guardan un patrón sistemático, más que aleatorio, los cálculos de las SSDs sobre todo el grupo de datos no resultan un método adecuado para comparar modelos bidimensionales, ya que son mediciones unidimensionales. Un patrón de desviaciones mayormente hacia un lado del modelo sobre algún rango de VO2, indica que el modelo es incorrecto en esa región en particular, es decir, que no tiene la forma correcta. Los análisis matemáticos de los dos modelos fueron llevados a cabo en diferentes sistemas coordenados; sin embargo, para su comparación, las curvas fueron transformadas, y las desviaciones son presentadas en el sistema coordenado lineal original ([La-] vs. VO2). La Figura 3 muestra las curvas de un sujeto (sujeto 1 del estudio de Beaver y cols. (50)) para los modelos continuo y de umbral, en el sistema coordenado lineal, ilustrando las diferencias entre los modelos. El modelo que exhibiese el mejor ajuste debería tener los puntos de datos eventualmente distribuidos alrededor del modelo de curva, y tener desviaciones asimétricas, con respecto al otro modelo, en una cantidad y dirección sugeridas por la diferencia entre los dos modelos. Medidos por las SSDs, los dos modelos tienen esencialmente ajustes iguales, en este caso (Tabla 1), pero la distribución de los puntos sugiere que el modelo de umbral es más adecuado, en el rango de tasas de esfuerzo mediano (cercanas al umbral).
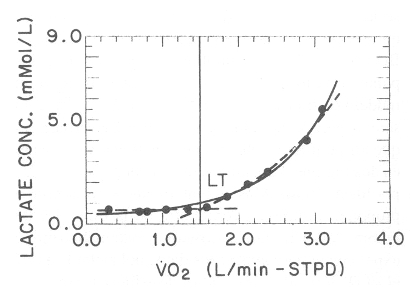
Figura 3. Gráfico del lactato vs. VO2 de un sujeto durante un test de
esfuerzo con incrementos cada un minuto. La curva sólida representa idealmente,
el modelo continuo, y la curva de guiones, de dos segmentos, al modelo de
umbral. Las líneas son las mejores curvas de ajuste de los modelos continuo y de
umbral para los puntos de los datos del sujeto 1 de la referencia 51. Ver el
texto para más detalles (Datos obtenidos con el permiso de Wasserman K, Beaver
WL, Davis JA, Pu JZ, Heber D, Whipp BJ: Lactate, pyruvate, and lactate-to-pyruvate
ratio during exercise and recovery. J Appl Physiol 1985; 59: 935-940).
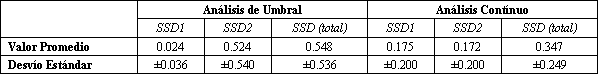
Tabla 1. Sumatoria de los cuadrados de las desviaciones a partir del
análisis del modelo de umbral y del modelo exponencial continuo de lactato vs.
VO2*. (*) Durante ejercicios progresivos, en 10 sujetos normales; los datos
individuales se encuentran en la referencia 51. Las SSDs son la suma al cuadrado
de las desviaciones de los puntos del modelo. SSDs 1 es la SSDs de los puntos
inferiores al umbral de lactato, y SSDs 2 es la SSDs por sobre el umbral,
detectados con el análisis de umbral.
Los gráficos de los 10 sujetos, similar a la Figura 3, podrían dar una estimación acerca de los patrones de desviación, pero el número limitado de datos disponibles en cada estudio, y las fluctuaciones aleatorias en los datos experimentales, hacen muy difícil su interpretación. Se puede obtener una mejor idea de estos patrones sistemáticos de desviaciones integrando todas las desviaciones de los 10 sujetos en un solo gráfico compuesto (Figura 4). Para visualizar cada patrón de desviaciones relacionadas con el LT, es necesario desplazar la ubicación de los puntos en el eje de las x, para que coincidan todos los LT. También es útil escalar la coordenada del VO2 en cada caso, para que todos los estudios tengan la misma distancia en el eje de las x, por sobre y por debajo del LT. De esta manera, los sujetos con diferentes capacidades de esfuerzo son comparables con la misma base. Cada punto, tal como en la Figura 3, es ubicado relativo a la curva del modelo apropiado en su localización en el eje x (Figura 4). Los resultados se muestran en las Figuras 4 A y 4 B, en las cuales las líneas sólidas representan los modelos idealizados. Cada punto es ubicado con la misma desviación que el sujeto presentó en su gráfico individual (por ej. en la Figura 3). Sería de esperar que el modelo, que precisamente ajustara los puntos experimentales, tuviera desviaciones que aleatoriamente estuvieran distribuidas alrededor de la curva del modelo. Sólo con mirar los gráficos, se ve que el modelo de umbral brinda un mejor ajuste de los datos que el modelo continuo en la región cercana al LT. En el modelo continuo, los puntos están sistemáticamente por debajo de la curva en la región del LT, y no distribuidos en forma más aleatoria, como en el modelo de umbral. Estas observaciones indican que el incremento de lactato tiene una dinámica de umbral. Sin embargo, este modelo de umbral no es tan preciso en la representación de los datos en la parte superior del rango del VO2, como lo es en la zona de umbral. De hecho, la distribución de las desviaciones indica que el modelo matemático podría no brindar una suficiente curvatura por encima del LT, y esto sería debido, principalmente, al hecho de que la última muestra de sangre se extrae al final del ejercicio (punto de agotamiento), cuando el VO2 tiende a aplanarse.
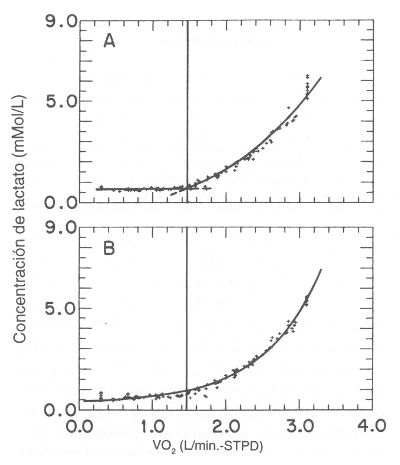
Figura 4. Figura que muestra graficación compuesta de la concentración de
lactato vs. VO2, representando todos los datos de los 10 sujetos estudiados en
la referencia 50. Las curvas representan los mejores ajustes de los datos de
modelos exponenciales de umbral (A) y contínuo (B) (ver Figura 3). Los datos son
distribuidos con la misma desviación relativa a las curvas, como fueron
distribuidos en los análisis individuales. Notar que los puntos para el modelo
continuo (B), los puntos a nivel VO2, en la región del umbral, caen por debajo
de la curva, mientras que los puntos caen alrededor de la curva en el modelo de
umbral (A). Ver el texto para mayor explicación. (Datos obtenidos con el permiso
de Beaver WL, Wasserman K, Whipp BJ: Improved detection of lactate threshold
during exercise using a log-log transformation. J Appl Physiol 1985; 59:
1936-1940).
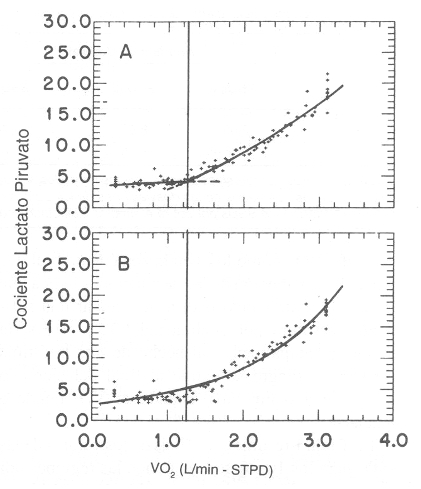
Figura 5. Gráficas que muestran la comparación compuesta de la proporción
lactato/piruvato vs. VO2, representando todos los datos de los 10 sujetos
estudiados en la referencia 51. Las curvas sólidas son las mejores curvas de
ajustes de puntos, que describen a los modelos de umbral (A), y exponencial
continuo (B), como se muestra en la Figura 4. Los datos son distribuidos con la
misma desviación relativa a las curvas, como fueron distribuidos en los análisis
individuales. Notar que los puntos en la región del umbral son sistemáticamente
bajos en el modelo exponencial continuo. (Datos obtenidos con permiso de Wasserman K, Beaver WL, Davis JA, Pu JZ, Whipp BJ: Lactate, pyruvate, and
lactate-to-pyruvate ratio during exercise and recovery. J Appl Physiol 1985; 59:
935-940).
La Tabla 1 resume el análisis de los valores de las SSDs para los 10 sujetos, en donde las regiones por debajo de (SSDs 1) y por sobre (SSDs 2) del LT son calculadas en forma separadas y agregadas para dar la SSDs total. Estos resultados corroboran las observaciones sobre los patrones de desviación de la Figura 4. El modelo de umbral tiene una SSDs significativamente menor (p<0,05) por debajo del LT, mientras que el promedio total de las SSDs de los dos modelos no fue significativamente estadístico (p>0,3), posiblemente debido a la gran variación individual. Los resultados de un análisis similar sobre la proporción entre las concentraciones L/P para los mismos sujetos, se muestran en la Figura 5 y en la Tabla 2. Para esta variable, el modelo de umbral brinda un ajuste significativamente mejor que el modelo continuo, tanto por debajo como por sobre el LT. El promedio de umbral detectado en el análisis de la proporción L/P fue de 1,44 ±0,35 l/min, en comparación con 1,49 +/- 0,30 l/min para el LT. El protocolo experimental de Hughson y cols. (44) podría haber ocultado el umbral. Sus mediciones de lactato fueron hechas a través de sangre venosa, obtenidas en sangre arterializada de una vena (vena de la mano), mientras tanto que nuestras muestras fueron obtenidas directamente de la arteria braquial. Se puede esperar que a partir de sangre venosa, la mezcal de lactato con agua tisular en el lecho capilar, pueda producir un retraso en el incremento y en el aplanamiento del incremento de la concentración de lactato relativo a cambios dinámicos en la concentración de lactato arterial. Además la tasa de aumento de esfuerzo en el estudio de Hughson y cols. (44) fue muy rápida, requiriendo un incremento de VO2 cada minuto de 0,5 l/min, en comparación con nuestro estudio, en el cual el aumento de VO2 por minuto era de aproximadamente 0,15 l/min. Esto tendería a disociar la tasa metabólica celular y el incremento de lactato venoso en vena de la mano. Esto es particularmente cierto, cuando se acerca al VO2 máx., en donde un rápido aumento de lactato puede ser acompañado por un relativamente pequeño aumento de VO2. En resumen, comparando los métodos exponenciales umbral y continuo, encontramos evidencias claras de la existencia de un umbral que puede ser localizado analizando la transformación logarítmica de los cambios de lactato en respuesta o en función del VO2 (50). La principal evidencia de este umbral está en los patrones sistemáticos de las desviaciones de los puntos de los modelos de análisis. El modelo de umbral (Figura 4 A) ubica los datos en forma bastante precisa hasta la zona del umbral, esto es, entre el 80 y 90% del VO2 máx. Los patrones de desviaciones del modelo continuo (Figura 4 B) también sugieren la existencia de un umbral, ya que las desviaciones de los puntos son predominantemente negativas al LT esperado, es decir, aproximadamente al 50% del VO2 máx. Cualquier ventaja aparente del modelo continuo derivada del análisis estadístico unidimensional se debe a la poca cantidad de datos (los valores más altos), en todo el estudio (10 sujetos). Nosotros hemos usado previamente el LT como una medición indirecta del VO2, al cual aumenta la proporción del L/P. En este estudio, los patrones de desviación de la proporción L/P (Figura 5), apoyados con análisis estadísticos (Tabla 2), confirman la existencia de un umbral. Sin embargo, los datos de L/P tienden a tener un mayor nivel aleatorio, debido a que las grandes, y no correlacionadas, fluctuaciones en las mediciones de lactato y piruvato contribuyen a la fluctuación en la proporción L/P. Esto, por supuesto, afecta la precisión en la determinación del umbral. Utilizando la transformación log-log, la tasa L/P tiene un punto de umbral, aproximadamente al mismo nivel de VO2 que se relaciona con el punto de inflexión o ruptura, a partir del cual se incrementa el lactato (Figura 6).
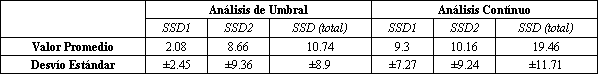
Tabla 2. Promedio de las sumas de los cuadrados de las desviaciones (SSDs)
de los análisis del Modelo de Umbral y del Modelo Exponencial Continuo del
cociente lactato/piruvato vs VO2*. (*) Durante ejercicios progresivos para 10
sujetos normales; los datos individuales se encuentran en la referencia 51. Las SSDs son la sumatoria de los cuadrados de las desviaciones de los puntos del
modelo. SSDs 1 es la SSDs de los puntos inferiores al umbral de lactato, y la
SSDs 2 es la SSDs por sobre el umbral, detectados con el análisis del umbral. LT
es umbral de lactato.
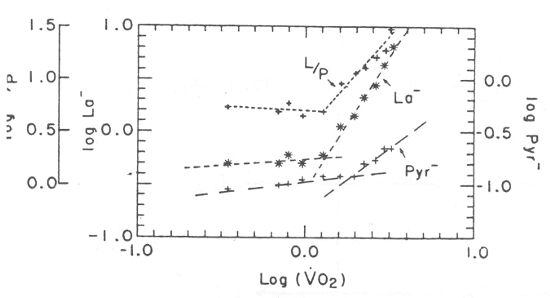
Figura 6. Gráfico del lactato arterial, piruvato y proporción lactato/piruvato
versus log VO2 de un sujeto, durante un test de esfuerzo progresivo. Hay dos
diferencias notorias entre los gráficos de piruvato y lactato, esto es, el punto
de ruptura del piruvato ocurre con tasas más altas de VO2 (o intensidad de
esfuerzos) que el lactato, y la pendiente del segundo componente del piruvato (o
parte de la curva luego del punto de ruptura) es menor que el equivalente
componente del lactato. La proporción lactato/piruvato no aumenta hasta que
ocurre el punto de ruptura del lactato. (Datos obtenidos con permiso de
Wasserman K, Beaver WL, Davis KA, Pu JZ, Heber D, Whipp BJ: Lactate, pyruvate,
and lactate-to-pyruvate ratio during exercise and recovery. J Appl Physiol 1985;
59: 935-940).
Por debajo de este punto de ruptura, el lactato aumenta en forma muy leve en la misma proporción que el piruvato, durante un test de esfuerzos progresivos. Sin embargo el piruvato tiene un punto de ruptura a un VO2 mayor, lo que podría representar el comienzo de la producción de piruvato a partir de lactato, por acción en masa de los tejidos en los cuales el potencial redox es relativamente alto, es decir, en los tejidos que no están realizando esfuerzo. Esto es similar al fenómeno producido al comienzo de la recuperación, cuando el lactato y el piruvato cambian en direcciones opuestas, a medida que el lactato es convertido en piruvato (51). La razón por la cual nosotros utilizamos un método matemático más que visual para determinar el VO2, a partir del comienzo del ascenso brusco de la curva de lactato durante el ejercicio, es porque puede haber un leve incremento de lactato a tasas de esfuerzos muy suaves, y los puntos del LT seleccionados por muchos investigadores pueden ser subjetivos. Creímos necesario un método matemático. Este estudio demuestra que la transformación log-log del lactato vs. VO2, permite observar el VO2 a partir del cual incrementa la tasa L/P. A pesar de que la concentración de lactato en LT puede ser levemente superior al reposo (Figura 6), hemos observado, en promedio, que dicha concentración es similar a la de reposo (Tabla 3).

Tabla 3. Promedio de las concentraciones de lactato durante reposo, el
umbral de lactato, y el umbral anaeróbico por intercambio gaseoso*. (*) Los
valores están en meq/l y equivalen a estudios de esfuerzos progresivos en 10
sujetos normales; datos provenientes de la ref. 37.
EL CAMBIO EN EL TIPO DE FIBRA Y EL AUMENTO DE GLUCOLISIS COMO FACTORES POTENCIALES QUE CONTRIBUYEN AL AUMENTO DEL LACTATO
Se ha sugerido que modificaciones en el tipo de fibras, en esfuerzos superiores al LT, puede ser un mecanismo potencial del incremento de lactato. Sin embargo, Radda (58), utilizando una espectrocospía de P31 con Resonancia Magnética Nuclear para estudiar los cambios de pH en fibras musculares lentas y rápidas, observó que ambos tipos de fibras experimentan una disminución en el pH, ante una misma tasa de esfuerzo. También Saltin y cols. (47) observaron que la distribución de los tipos de fibra cambiaba, solamente en forma leve, influido por un período de entrenamiento, al margen de una marcada reducción en la producción de lactato de los grupos musculares entrenados. Además, es difícil recurrir a la hipótesis del tipo de fibra para explicar el incremento de la proporción L/P, que ocurre con el aumento de lactato en LT. Sin embargo, la magnitud de aumento de lactato ante altas tasas de esfuerzo podría estar influenciada por la frecuencia de reclutamiento del tipo de fibra, a pesar de que esto no indicaría el comportamiento del umbral. Algunos investigadores sugieren que el lactato puede aumentar, simplemente por el efecto de la acción en masa causada por el aumento de la glucólisis (43). Sin embargo, a pesar de que la hiperventilación puede producir un pequeño aumento en el lactato sanguíneo (en comparación con el ejercicio muscular), como resultado de la estimulación de la enzima regulatoria, la fosfofructokinasa, la alcalosis hipocápnica no ocurre normalmente a nivel del LT. Además, cambiando sustratos musculares (61) y estimulando el metabolismo del piruvato a través de la infusión de bicloroacetato en humanos (estimula la piruvato-dehidrogenasa) (62), han mostrado no tener ningún efecto sobre el LT.
EFECTO DE LA ACUMULACION DE LACTATO SOBRE EL INTERCAMBIO GASEOSO
Durante un ejercicio por debajo del UA, el CO2 producido está en función de la tasa metabólica, o consumo de oxígeno, y del sustrato energético (Figura 7 A). A altas intensidades, durante las cuales los mecanismos anaeróbicos suplementan a los aeróbicos, se comienza a producir ácido láctico. Debido a que el ácido láctico es altamente disociado en el medio acuoso en el citoplasma celular, más del 99% debe ser tamponado. La Figura 8 muestra el aumento de lactato y la disminución de HCO3- en la sangre arterial. El primer aumento de 0,4 meq/l en el lactato celular es aparentemente taponado por buffers intracelulares, teniendo un pK aproximadamente igual que el pH del agua celular, ya que el lactato comienza a aumentar levemente antes que el HCO3- comienze a disminuir (60). Luego de esta demora, se ha visto que mayores incrementos de ácido láctico son tamponados por HCO3- en forma estaquiométrica (60). El CO2 adicional, generado por el tamponamiento de ácido láctico por el HCO3-, se acumula en cantidades de 22,4 ml de CO2 por cada mili equivalente de aumento de lactato. Esta es una cantidad importante de CO2 producido, en relación a lo que podría haber sido producido aeróbicamente (63), y en general se puede medir fácilmente a través del aire espirado. Se puede ver claramente, que el tamponamiento de ácido láctico (acción buffer), se produce en el citoplasma de la célula, principalmente por el HCO3- (Figura 7 B), y esta es la base de la conexión entre el intercambio gaseoso y la producción de ácido láctico. Cuando la concentración de lactato comienza a crecer, luego de un retraso aproximado de 0,5 meq/l en sujetos normales, la concentración del HCO3- empieza a caer, y el VCO2 aumenta en forma más vertical que el VO2 (Figura 9). El rol principal del HCO3- como sustancia buffer del ácido láctico, es probablemente también importante desde el punto de vista de la osmolaridad celular. La acumulación de lactato intracelular aumentará la presión osmótica de la célula y causará la expansión de las células musculares, a menos que disminuya, en forma simultanea, otra especie osmolar. Sólo la sustancia buffer volátil (HCO3-) tiene esta característica. La Figura 10 muestra los cambios simultáneos de lactato, HCO3- estandar, y VO2, en función del VO2 en el sujeto. La pendiente de la relación VCO2 menos VO2 (gráfico de pendiente V) es evidente cuando el lactato comienza a aumentar y el HCO3- a disminuir. El punto de ruptura en la curva se aproxima a los umbrales de lactato y HCO3- (a pesar de que el primero se produce en poco antes, como se describió previamente), determinados por la transformación log-log descripta por Beaver y cols. (37) para sujetos normales, y el umbral de HCO3- obtenido, como muestra Sue y cols. (64) para sujetos normales y pacientes con enfermedades pulmonares. A pesar de que el tamponamiento de ácido láctico formado durante el ejercicio debería ocurrir en la célula, Knuttgen y Saltin (54), Jorfeldt y cos. (53), Lindholm y Saltin (55), y Chwalbinska-Moneta y cols. (56), todos, han mostrado que el incremento de lactato en la sangre arterial ocurre sin mayor demora con respecto a su aumento en la célula muscular (aunque Green y cols. (65) no llegaron a esta misma conclusión). El cambio recíproco entre el HCO3- arterial y el lactato, mostrado en las Figuras 8 y 10, posiblemente ocurre con un mecanismo de intercambio de aniones entre el agua celular y extra celular, ya que la disminución del HCO3- celular y el aumento del lactato celular crean los potenciales electroquímicos necesarios para el movimiento de estos aniones en las direcciones mostradas en la Figura 7 B. Sin embargo, con tasas de esfuerzo cercanas al agotamiento, la gran tasa de producción de lactato intramuscular podría no reflejarse, en forma exacta, en la sangre arterial (54).
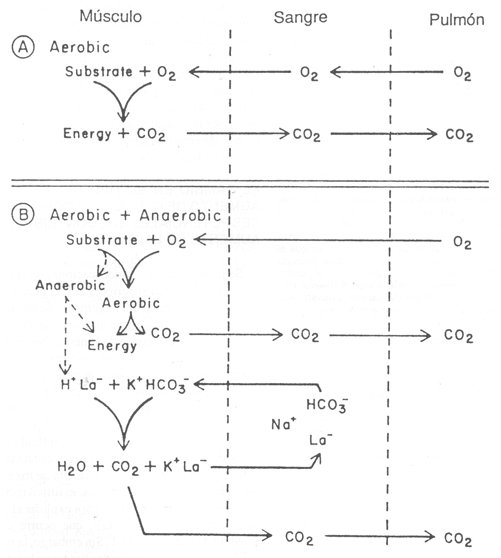
Figura 7. Diagrama que muestra las reacciones que involucran el
intercambio de O2 y CO2 entre los pulmones y las células
musculares, durante el ejercicio en el cual el aporte de O2 es
adecuado para obtener todos los requerimientos energéticos a través de los
mecanismos aeróbicos (panel A), y en el cual se requiere de los mecanismos
anaeróbicos (panel B). Para el trabajo aeróbico, la proporción de la producción
de CO2 contra el consumo de O2 de las células musculares,
depende del cociente respiratorio del sustrato utilizado para energía (panel A).
La producción de CO2 aumenta con el ejercicio que requiere, tanto de
los procesos anaeróbicos como aeróbicos; el grado depende de la tasa de
acumulación de lactato (panel B). En las células se forma el CO2
derivado del tamponamiento de ácido láctico por HCO3-. El
CO2 producido por este mecanismo se genera solamente durante el
período en que aumenta el lactato. El lactato y el HCO3-
se intercambian a través de la membrana celular, a medida que el lactato
intracelular aumenta, y el HCO3- disminuye en relación con
las concentraciones extra celulares. (Reimpreso de: Wasserman K, Hansen JE, Sue
DY, Whipp BJ: Principles of Exercise Testing and Interpretation. Philadelphia,
Lea & Febiger, 1987, p. 7).
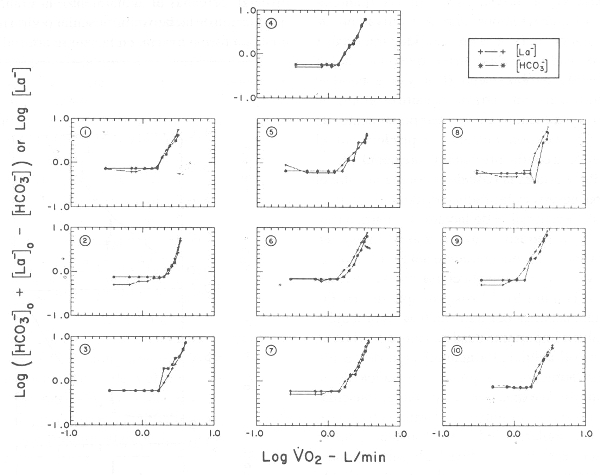
Figura 8. Gráfico log-log de los cambios de bicarbonato (HCO3-)
y lactato arterial vs. VO2. Log HCO3- es
graficado como la diferencia con el HCO3- en reposo y
luego normalizado a la concentración de lactato en reposo, [La-] o,
para que las dos curvas pudieran superponerse. (Reimpreso con permiso de: Beaver
WL, Wasserman K, Whipp BJ: Bicarbonate buffering of lactic acid generated during
exercise. J Appl Physiol 1986; 60: 472-478).
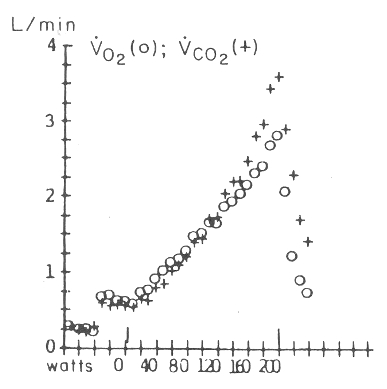
Figura 9. VCO2 y VO2 en relación con la tasa de
esfuerzo de un test en bicicleta ergométrica, con incrementos de carga cada
minuto (20 W/min). El VCO2 comienza a aumentar más verticalmente que
el VO2, a medida que aumenta la tasa de esfuerzo, en el rango de
esfuerzos medianos, reflejando un tamponamiento del ácido láctico por sobre el
umbral anaeróbico.
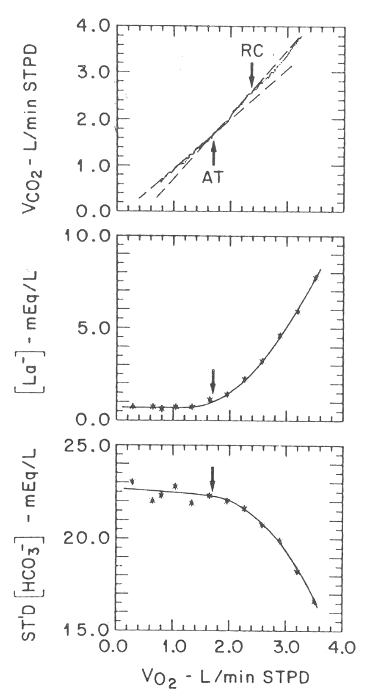
Figura 10. Gráficos de las concentraciones de lactato arterial y HCO3-
Standard y de VCO2, en función del VO2 en un sujeto. Las
flechas indican el UA (AP), estimado a partir del gráfico del VCO2
vs. VO2, los que también representan una estimación razonable del
incremento del lactato y la disminución del HCO3- vs. VO2.
BALANCE ENTRE LA OXIGENACION DE LOS TEJIDOS (CONSUMO DE OXIGENO) Y LOS REQUERIMIENTOS DE OXIGENO
Las evidencias científicas demuestran que existe una dinámica de umbral para las proporciones L/P, para el lactato, y para las respuestas de intercambio gaseoso ventilatorio y pulmonar, en respuestas a esfuerzos. Aún no se puede establecer, con la actual tecnología, si el mecanismo de estos cambios es una anaerobiosis local (regional). Sin embargo creemos, por los datos existentes, que esto es así, (25-34, 40, 49). Ahora consideraremos el balance entre el consumo y los requerimientos de oxígeno. A pesar de que la mitocondria puede funcionar con un PO2 extremadamente bajo (1 mmHg) (46), la capacidad del O2 para generar energía oxidativa no puede ser medida en términos de presión parcial del tejido. Más bien, la pregunta principal sería si el incremento del requerimiento de O2 muscular de las fibras contráctiles, durante un ejercicio, se puede alcanzar con una transferencia en masa de O2 a la mitocondria muscular, en cantidades suficientes para mantener una presión parcial adecuada a la tasa requerida para la producción de fosfatos de alta energía. Caminando a una velocidad de 3 millas/h, la transferencia en masa de O2 de los capilares a las mitocondrias se debe incrementar, aproximadamente 20 veces con respecto al reposo. Los mecanismos que determinan esta transferencia de los capilares a las mitocondrias se conocen como Ley de Difusión de Fick. Esta ley establece que la transferencia en masa (D) de una sustancia, como el O2, es directamente proporcional a la diferencia de presión parcial entre el punto de alta presión en los capilares (Pc) y el punto de baja presión en las mitocondrias (Pm), o sea Pc-Pm, y el área de superficie (A) (grado de hiperemia); e inversamente relacionada con la distancia de difusión (L) (capilar a mitocondria). La constante de proporcionalidad (k) es una función de la difusión y solubilidad del O2 en la sustancia del tejido; o sea, DO2= k. (pc-Pm).A/L. Debido a que los requerimientos de O2 mitocondrial son continuos, siempre debe haber una adecuada diferencia de presión parcial entre los capilares y las mitocondrias. De acuerdo a los datos obtenidos por Bylund-Fellenius y cols. (38), se observa que la proporción L/P muscular permanece en niveles de reposo hasta que el PO2 del tejido muscular disminuye a aproximadamente 8 mmHg, punto a partir del cual aumenta rápidamente. Debido a la presión de O2 necesaria para permitir la dirección del flujo adecuada, el PO2 mitocondrial debe ser menor a 8 mmHg, y el PO2 capilar debe ser mayor para evitar la anaerobiosis. Se ha demostrado que la mitocondria puede funcionar con niveles de PO2 tan bajos como 1 mmHg (46). Como una hipótesis, se puede presumir que, a medida que la sangre recorre los capilares a distintos niveles de esfuerzo, se debe mantener el PO2 capilar por sobre los 8 mmHg para evitar la anaerobiosis en humanos (38).
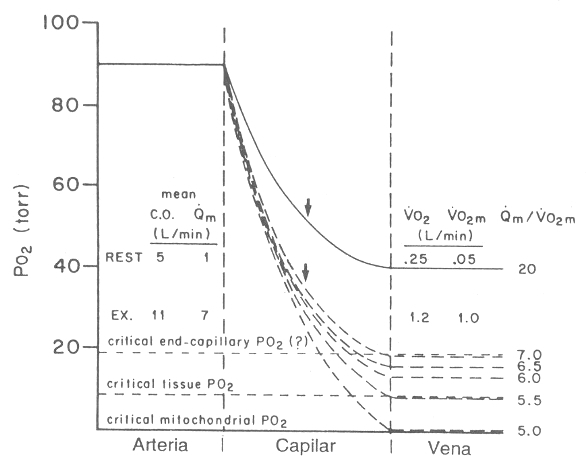
Figura 11. Modelo conceptual de las relaciones de la presión parcial de O2
capilar muscular, a través de capilares musculares representativos, durante un
ejercicio. Se asume una concentración de hemoglobina de 15 g/dl (hematocrito
45), un PO2 arterial de 90 mmHg, y un VO2 muscular (VO2
m) de 1 l/min (correspondiente a un adulto que camina a una velocidad de 3
millas/h). Las curvas son los limites del PO2 a lo largo de los
capilares, para varias tasas de perfusión muscular (Qm) en relación al consumo
de O2 muscular (VO2 m) (valores de Qm para 1 l/min de VO2).
El PO2 de cada curva es calculado en base a la curva de disociación
de la oxi-Hb, a medida que el contenido de O2 sanguíneo disminuye de
acuerdo a su tasa Qm/VO2 m. Notese que el PO2 capilar
finales más afectada que la media del PO2 capilar, a medida que Qm/VO2
varía. El PO2 capilar crítico, por debajo del cual el aporte de O2
a las mitocondrias es inadecuado, varía con el consumo de O2
muscular. A pesar de que la diferencia de presión arterial entre la fuente de O2
(capilares) y el desagote de O2 (mitocondrias) es el determinante
crítico de la transferencia en masa del O2, la distancia entre ellos
y el área de superficie también son factores importantes. (Ver el texto para la
discusión sobre el PO2 crítico, en relación al Qm/VO2 m).
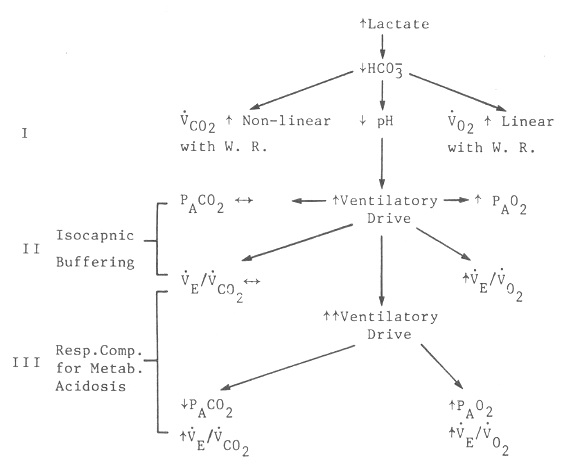
Figura 12. Diagrama de efectos del aumento de la acumulación de lactato
sobre el intercambio gaseoso durante un test de ejercicios progresivos. Las
flechas pequeñas dirigidas hacia arriba indican incrementos, las flechas
pequeñas hacia abajo indican disminuciones, y las flechas horizontales indican
que no hay cambios. El mecanismo I describe el intercambio gaseoso que resulta,
solamente del tamponamiento del nuevo ácido láctico formado. El mecanismo II
describe los cambios del PCO2 y PO2 alveolar y residual, y
los equivalentes ventilatorios para el O2 y el CO2, que
resultan de un aumento en el flujo ventilatorio como consecuencia del CO2
generado por la reacción de tamponamiento. El mecanismo III describe los cambios
causados por mayores aumentos en el flujo ventilatorio como consecuencia de la
compensación respiratoria por la acidosis metabólica. (Reimpreso de: Wasserman
K, Hansen JE, Sue DY, Whipp BJ: Principles of Exercise Testing and
Interpretation. Philadelphia, Lea & Febiger, 1987, p 34).
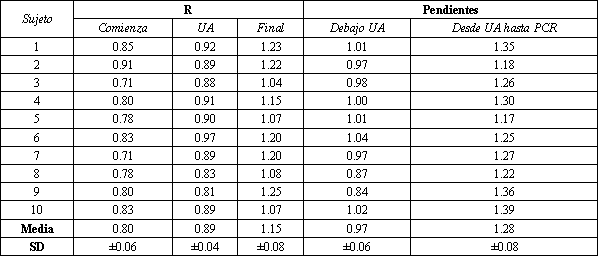
Tabla 4. Valores de R (VCO2/VO2) a las tasas de
esfuerzo más bajas (ciclismo sin resistencia), el umbral anaeróbico (UA), y al
final de un test de esfuerzos con aumentos progresivos cada minuto (15 W/min); y
las pendientes de las curvas de VCO2 vs VO2 por debajo del
UA, y entre el UA y el punto de compensación respiratoria (PCR), es el VO2
por sobre el cual el equivalente respiratorio para CO2 (VE/VCO2)
comienza a aumentar, y el PCO2 arterial y el PCO2 de final
de volumen (end-tidal) comienzan a disminuir.
En la Figura 11 se muestra un modelo conceptual de las relaciones de la presión parcial del O2 capilar, en donde se ve un límite del PO2 a lo largo de un grupo de capilares musculares representativos, durante un ejercicio. Este modelo se basa en el consumo de O2 de los músculos (VO2 m) relativo al flujo sanguíneo muscular (Qm) y a la forma de la curva de disociación de la oxihemoglobina. El modelo en la Figura 11 presume una concentración de hemoglobina de 15 g/dl, un PO2 arterial de 90 mmHg, y un VO2 m de 1 l/min (correspondiente a un sujeto normal que camina a razón de 3 millas/h). Este modelo ilustra la capacidad del aporte de O2 a los músculos en ejercicio (Qm x contenido de O2 arterial) para alcanzar los aumentos de la tasa metabólica (VO2 m), durante el ejercicio. Se debe observar que 5,1 l de sangre con 15 g de hemoglobina/dl y 97% de saturación contienen solamente 1 l de O2. Debido a que no es posible absorber todo el O2, se necesita un flujo sanguíneo muscular mayor que 5,1 l/min por cada litro por minuto de VO2 m para evitar la anaerobiosis obligada a este nivel de esfuerzo. La Figura 11 muestra que el PO2 capilar final alcanza los 8 mmHg con una proporción Qm/VO2 m de 5,5 Andersen y Saltin (66), midieron la tasa Qm/VO2 en el cuadriceps femoral durante un trabajo gradual de extensión de rodilla, y observaron que variaba desde 7,1 (con las tasas más altas de esfuerzo) hasta 7,8 (con las tasas más bajas). Lo comúnmente reportado para la pendiente de 6 para el aumento del volumen minuto cardíaco por litro de aumento en el consumo de O2, en respuesta al ejercicio (67), corresponde a una proporción Qm/VO2 m de 7, cuando el costo de O2 muscular es de 1 l/min (Figura 11). Esto asume que no hay una reducción neta del flujo sanguíneo a los otros tejidos (descenso del flujo esplácnico sanguíneo con un consecuente aumento en el flujo coronario y de la piel) (68). Esto se acerca a lo medido por Andersen y Saltin (66). Un Qm/VO2 m de 7 resultaría en un PO2 capilar final de 18 mmHg, presumiendo una uniformidad de Qm/VO2 m a través del músculo (Figura 11). Si ocurre una perfusión no uniforme, causando una perfusión relativa a la tasa metabólica menor que 6 en algunas regiones, a pesar de la hiperemia máxima, tendrá lugar el metabolismo anaeróbico. Cuando la vasodilatación es máxima, el PO2 capilar debe aumentar a medida que aumenta el flujo de O2 requerido por la mitocondria para la producción de energía (ecuación de difusión de Fick). Esto sólo puede ocurrir con un incremento del flujo sanguíneo o con el desplazamiento de la curva de disociación de la oxihemoglobina hacia la derecha. Si el PO2 capilar no aumenta proporcionalmente con el aumento de los requerimientos de O2, tendrá lugar la anaerobiosis. El modelo mostrado en la Figura 11 también ilustra la disminución del PO2 sanguíneo a lo largo del capilar. Es evidente que el PO2 capilar final está afectado en un mayor porcentaje que el PO2 capilar medio por una distancia de las proporciones Qm/VO2 m. Además, las técnicas que miden el PO2 capilar medio o de los tejidos (42) pueden fallar fácilmente en la detección de unidades musculares con cocientes Qm/VO2 m críticamente bajos. La falla en considerar los factores variables que afectan la transferencia de O2 de la sangre a las mitocondrias, a llevado a la idea que el PO2 venoso es demasiado alto para considerar a la circulación como la limitante y responsable del incremento de lactato durante el ejercicio (45, 66). Este concepto es obviamente erróneo, ya que no considera el aumento en la presión de difusión necesaria para el O2, ante niveles de ejercicio progresivo luego de la máxima vasodilatación. En este análisis, hay una incertidumbre con respecto a cual es el PO2 capilar crítico por debajo del cual se desarrolla la anaerobiosis. Sin embargo, el modelo ilustrado en la Figura 11 y la Ley de difusión de Fick, nos recuerdan que “ningún valor de PO2 puede ser crítico en el capilar, por debajo del cual ocurra la anaerobiosis, no importa cual sea la tasa metabólica”. El PO2 que es crítico con respecto a satisfacer los requerimientos de O2 varía con el VO2 m, el grado de hiperemia, la densidad mitocondrial (cambios mayores durante el entrenamiento), y la longitud de la vía de difusión. Además, un PO2 superior al adecuado para que la mitocondria funcione en un tubo de ensayo con respiración en estado 3, no significa que sea adecuado para la mitocondria “in situ”, cuando el metabolismo es estimulado y el O2 debe pasar a través de otro tejido para alcanzarlas. El hecho de que los atletas no tengan un mayor flujo sanguíneo muscular que las personas sedentarias con tasas de esfuerzo submáximas, y que el entrenamiento reduzca la producción de lactato muscular sin cambiar el flujo sanguíneo, no significa que el aumento de lactato sea independiente del aporte de O2 (45). El flujo sanguíneo muscular determina el PO2 capilar y, por lo tanto, la presión del O2 de los capilares a las mitocondrias. El hecho de que la diferencia de presión parcial sea adecuada para prevenir la anaerobiosis depende del consumo de O2 de los grupos musculares, como se describió previamente. Cuanto mayor número de mitocondrias por unidad de volumen muscular, menor será la distancia de difusión y por lo tanto, menor la posibilidad de que se desarrolle la anaerobiosis para una determinada diferencia de PO2 capilar-mitocondrial. El consumo de O2 y el flujo sanguíneo durante el ejercicio tienen una relación relativamente fija, sin importar el grado de entrenamiento, ya que ambos fenómenos son interdependientes como se refleja en la ecuación: Flujo sanguíneo= consumo de O2/diferencia de O2 arterio-venosa. Si la densidad mitocondrial aumenta como consecuencia del entrenamiento, el consumo de O2 será el mismo, pero la presión necesaria para satisfacer los requerimientos de O2 será menor.
MEDICIONES NO INVASIVAS DEL UMBRAL DE ACIDOSIS METABOLICA (UMBRAL ANAEROBICO)
La evaluación del UA a través de métodos de intercambio gaseoso depende, de alguna manera, del protocolo de ejercicios. Un protocolo en el cual la tasa de esfuerzo se aumenta en forma muy leve, puede resultar en incrementos muy pequeños de lactato. El UA puede ser medido rápidamente a través de técnicas de intercambio gaseoso usando un test con cargas de esfuerzo progresivas en el cual estas cargas son aumentadas, desde las más bajas hasta las de esfuerzos límites, en aproximadamente 8-12 minutos. En la Figura 12 se muestra un diagrama de flujo que describe el fenómeno de intercambio gaseoso que acompaña al desarrollo de la acidosis metabólica durante un test de esfuerzos progresivos. Los tres mecanismos fisiológicos de las alteraciones en el intercambio gaseoso pueden ser identificados, consecuentes al desarrollo de la acidosis láctica durante un test de esfuerzos rápidos y progresivos, son: 1) mecanismo I, aumento de VCO2 relativo al VO2, debido al tamponamiento (buffer) celular; 2) mecanismo II, aumento de la ventilación como respuesta al aumento del VCO2, a partir del tamponamiento con regulación del Pa CO2 (buffering isocápnico); y 3) mecanismo III, compensación respiratoria por la acidosis metabólica con disminución del PaCO2.
Mecanismo I
El método para detectar el UA a través del mecanismo I se denominó análisis de la “pendiente de curva-V” (37), ya que compara los volúmenes del VCO2 con el VO2. Es confiable cuando se aplica a pacientes, ya que los cambios depende solamente de la reacción físico-química del tamponamiento de ácido láctico por el HCO3-, y son independientes de la sensibilidad quimiorreceptora respiratoria, o respuesta respiratoria al ejercicio. Además, el análisis de la curva-V mide el nivel de VO2 con el que se genera CO2 a partir del tamponamiento de ácido láctico. El VCO2 se grafica en función del VO2 (medido simultáneamente ventilación por ventilación), y el incremento en la curva (punto de ruptura) es identificado como se muestra en las Figuras 10 y 13. El término “umbral ventilatorio”, utilizado por algunos investigadores, es incorrecto para este punto de ruptura, ya que es independiente de la ventilación. El VCO2 por debajo del umbral, aumenta aproximadamente en forma lineal con el VO2 en una proporción consistente con el cociente respiratorio metabólico de los músculos; la pendiente es de 0,85 a 1,0 con un promedio de 0,97 para sujetos con una dieta normal (Tabla 4). Sin embargo, por sobre el UA la pendiente de la relación VCO2-VO2 es más vertical, a medida que el CO2, producido por el tamponamiento por el HCO3-, se agrega al CO2 producido por el metabolismo aeróbico (la pendiente es generalmente mayor a 1,15) (Tabla 4). Este componente más vertical de la relación VCO2-VO2 también se relaciona linealmente con el punto de compensación respiratoria (VO2, por encima del cual se produce la hiperventilación). El cambio de la curva más horizontal hacia una curva más vertical identifica el VO2 a partir del cual el ácido láctico comienza a ser tamponado por el HCO3- y, teóricamente, marca la transición del esfuerzo totalmente aeróbico, al esfuerzo aeróbico-anaeróbico (Figura 7 B). El análisis de la pendiente de la curva-V, como fue descripta originalmente para la detección del UA, excluía los cambios cinéticos al comienzo del período del incremento en la carga de esfuerzo (primer minuto, más o menos), y el período hiperventilatorio que resulta de la compensación respiratoria por la acidosis metabólica. Un programa de computadora seleccionaba a la intersección de las líneas de la regresión lineal de los dos componentes como el UA. Utilizando este método, observamos que el UA era levemente mayor que el umbral de lactato (UL). Para obtener el mismo valor de VO2 para el UL que para el UA, a través de la pendiente de curva-V, fue necesario subir 0,5 meq/l en la curva de lactato y determinar el VO2 a ese nivel. Nosotros observamos el siguiente mecanismo para esta diferencia: debido a que el pK de algunas de las sustancias buffer en las proteínas de las células podría ser el mismo que el pH celular, podría aumentar el H+ sin un cambio en el pH. Además, cuando la creatina PO4 se hidroliza, podría tomar parte del H+ producido a medida que aumenta la concentración de lactato. Esto podría explicar la diferencia sistemática en los umbrales de HCO3- y de lactato (37). Más precisamente, los métodos de intercambio gaseoso deberían reflejar la acidosis láctica más que el UL, siendo la diferencia el H+ del lactato, que puede ser removido sin un cambio en el pH celular. Se observó que el umbral de HCO3- no difiere significativamente del UA obtenido a través de mediciones del intercambio gaseoso (37). La pequeña diferencia sistemática entre los umbrales de lactato y de HCO3- y entre el UL y el UA, medidos a través del intercambio gaseoso, se puede ver en el trabajo de Beaver y cols. (Figura 3) (60). Debido a que la cantidad de CO2 generada a partir del tamponamiento es tan grande (aproximadamente 3,01 en exceso a la producción de CO2 aeróbico, por sobre el 50% de aumento en el rango de carga de trabajo, para un incremento de lactato de 5 meq/l), los patrones de respiración irregular, y aún la hiperventilación de grado moderado tienen muy poco efecto. A pesar de que el informe original (37), se omitieron en el análisis los datos superiores al punto de compensación respiratoria, es frecuente que los datos en esta zona caigan muy cercanos a la pendiente que los datos por debajo de este punto. Además, la curva entera usualmente se usa para un análisis visual. La zona superior de la curva no es lineal, una zona lineal por encima del punto de ruptura puede ser identificada y usada para su análisis, siendo el punto de ruptura el momento en que los datos comienzan a formar una pendiente mayor que 1,0. Como se muestra en la Figura 13, la parte superior de la curva puede tener más pendiente si se incrementa más rápido la tasa de esfuerzo. El incremento más rápido de ésta no tiene un efecto apreciable en la parte inferior de la curva, pero debido a que el lactato se formará más rápidamente con mayores cargas, la producción de CO2 a partir del buffer de HCO3- aumentará en una forma más veloz, relativa a la producción de CO2 a partir del metabolismo aeróbico. En vista de las consideraciones previas, aún con algunos pacientes con problemas cardíacos que respiran en forma periódica durante un ejercicio (Figura 14), observamos que podemos detectar visualmente el punto de ruptura con mayor certeza a través del análisis de la pendiente-V, que con el equivalente ventilatorio u otros métodos de intercambio gaseoso para detectar el UA (3). Como un análisis práctico, nosotros utilizamos las mismas escalas en ambas coordenadas para graficar VCO2 en función del VO2. Luego establecimos una recta a 45º (pendiente= 1) a través del origen o a través de los puntos, como se muestra en la Figura 14, para establecer el punto de ruptura que reflejaba el UA. En pacientes con enfermedades cardiovasculares severas, el punto de ruptura puede darse con niveles de VO2 muy bajos o podría no identificarse un bien definido componente bajo de la curva (Figura 15). Como los puntos forman una curva con una pendiente mayor que 1, sin una disminución pronunciada y abrupta de PCO2 de volumen final, el UA debería ser ya excedido. Además, el UA puede ser estimado por extrapolación de los componentes superiores del gráfico de la pendiente-V hacia abajo, hasta interceptar los puntos de los datos inferiores obtenidos experimentalmente, como se muestra en la Figura 15. De este modo, una línea perpendicular al eje del VO2, marcaría el UA. Recientemente, aplicamos el método visual con la pendiente-V, usando un triángulo recto de 45º, a pacientes con enfermedades obstructivas estables en las vías respiratorias (68). Para aquellos pacientes cuyo HCO3- arterial disminuía, el gráfico de VCO2 versus VO2 mostraba dos segmentos bien distintivos, cuya intersección ocurría a un VO2 (UA) similar al cual comenzaba a disminuir el HCO3- standard.
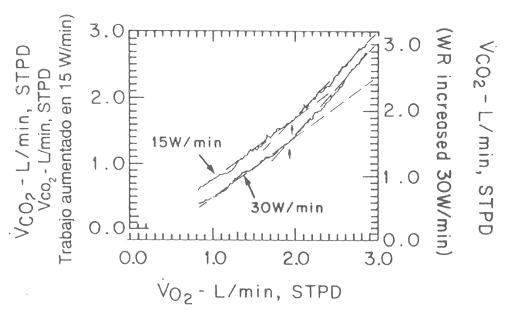
Figura 13. Gráfico del VCO2 vs. el VO2 en un test
de ejercicio progresivo con incrementos de 15 W/min y 30 W/min. Las mediciones
fueron realizadas ventilación por ventilación, y los datos son graficados como
un promedio de cada 8 seg de prueba. El umbral anaeróbico (UA) es determinado
por la intersección de los componentes lineales superiores e inferiores
(flechas). En el análisis se excluye la parte inferior no lineal de los datos ya
que representa el CO2 que se almacena en las reservas. A pesar de que
los puntos de ruptura de ambas curvas son muy similares, la pendiente de curva
del componente superior en el test de 30 W/min es más elevada que en el test de
15 W/min. Además, el UA se encuentra más fácilmente con el protocolo de 30 W/min
ya que el ácido láctico es producido más rápidamente, desarrollando, de esta
manera, más CO2 como consecuencia del tamponamiento de ácido láctico
por el HCO3-.
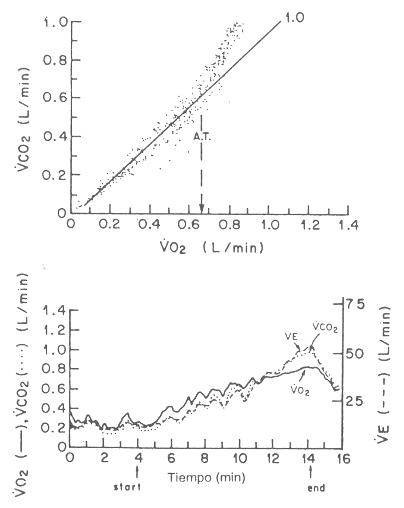
Figura 14. Gráfico (panel inferior) del VO2, VCO2 y
VE en un paciente adulto en respuesta a un test de esfuerzos
progresivos en bicicleta ergométrica, en el cual se muestra la respiración
irregular del paciente. Gráfico del VCO2 en función del VO2
(el análisis de la pendiente-V se muestra en el panel superior). La línea con
una pendiente de 1,0 es la media aproximada de datos hasta el punto en donde el
VCO2 rompe su linearidad y comienza a aumentar rápidamente. El VO2
a partir del cual los puntos aumentan en forma más pronunciada que la pendiente
de 1,0 es, en teoría, el VCO2 a partir del cual HCO3-
comienza a tamponar al ácido láctico, o el umbral anaeróbico.
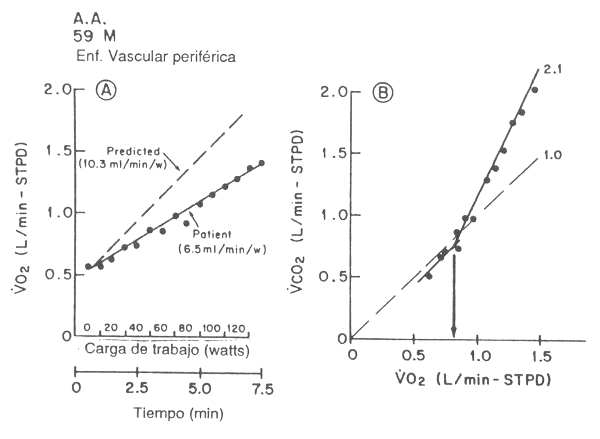
Figura 15. Gráficos que muestran los datos del intercambio gaseoso de un
paciente de 59 años con enfermedad periférica vascular. Los mismos muestran un
muy pequeño incremento de VO2 en respuesta al aumento en las tasas de
esfuerzo (Panel A). El Panel B muestra la pendiente-V de este estudio. Se dibujó
la pendiente de 1 para brindar una referencia visual de los puntos de datos
relativos al umbral anaeróbico. El VCO2 graficado en función del VO2
muestra una curva muy pronunciada, con una pendiente de 2,1; esto pone en
evidencia que el VCO2 es derivado del tamponamiento de ácido láctico,
tanto como del CO2 del metabolismo aeróbico. La extrapolación de los
puntos de datos del VCO2 vs. VO2 de la curva más
pronunciada a puntos más inferiores da una estimación del umbral anaeróbico.
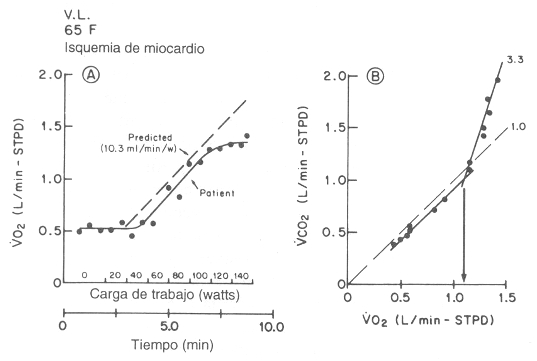
Figura 16. Consumo de O2 (VO2) graficado en función
de la tasa de esfuerzo (Panel A), y producción de CO2 (VCO2)
en función del VO2 (grafico de pendiente-V) (Panel B), de un paciente
de 64 años que tiene cambios en el segmento ST consistentes con una isquemia de
miocardio, pero sin dolor, durante ejercicios en bicicleta ergométrica con una
resistencia de 120 W. Debido al poco incremento de VO2 (Panel A) con
un continuo aumento del VCO2 por encima del umbral anaeróbico, la
curva con los componentes superiores del gráfico VCO2-VO2
(Panel B) es patológicamente elevada. Esta curva, con una pendiente de 3,3,
sugiere una tasa excepcionalmente alta de producción de lactato durante el
ejercicio. Se dibujó la pendiente de 1 en el Panel B para brindar una
visualización de la elevación en el gráfico VCO2-VO2
reflejando esto el comienzo del tamponamiento del ácido láctico por el HCO3-.
Mecanismo II
En el pasado, confiábamos principalmente en métodos que dependían de la respuesta ventilatoria al incremento de CO2 producido por el tamponamiento de ácido láctico para detectar el UA, durante un test de esfuerzos progresivos (Figura 12, mecanismo II) (69). Normalmente, el aumento de VO2 permanece relativamente lineal, mientras que VCO2 y VE marchan en forma paralela como consecuencia del control ventilatorio del PCO2 arterial. Además la tasa VE/VCO2 disminuye o no cambia, y la tasa VE/VO2 aumenta cuando se pasa el UA. Además, la tensión de CO2 de fin de volumen (Pet CO2) es relativamente constante, y la tensión de O2 de fin de volumen (Pet O2) aumenta, debido a que la tasa de aumento del VO2 permanece lineal, mientras que el VE se acelera, dando por resultado una hiperventilación con respecto al O2, pero no con respecto al CO2. Además, con un control respiratorio normal, la tasa VE/VO2 aumenta sin un aumento simultáneo en la tasa VE/VCO2. Por otro lado, Pet O2 aumenta sin una recíproca disminución de Pet Co2, ya que la compensación ventilatoria para la acidosis láctica, que causa una reducción de PaCO2, no ocurre hasta varios minutos más tarde para los tests de ejercicio con aumentos progresivos. Estas observaciones son indicadores específicos del desarrollo de la acidosis metabólica y distinguen este mecanismo de otras formas de hiperpnea con reducción aguda de Pa CO2 (hiperventilación), por ejemplo, en sujetos con síndrome de McArdle (70). En sujetos cuyos mecanismos de control ventilatorio responden adecuadamente al incremento de la producción de CO2, los métodos del mecanismo II para detectar el UA, son relativamente fáciles de usar. Desafortunadamente, algunas personas normales tienen quimiorreceptores insensibles, y el VE no sigue al incremento de VCO2 (37). Además, en pacientes con enfermedades pulmonares obstructivas, en general la Pa CO2 no disminuye en respuesta a la acidosis metabólica, y hasta puede aumentar. Por otro lado, en estos sujetos, la tasa VE/VO2 podría no elevarse en forma discernible al nivel del UA. Para agregar, los patrones irregulares de respiración impiden estimar un UA confiable a partir de este método (37). El análisis de la pendiente-V confía solamente en los efectos de tamponamiento y es independiente de la respuesta ventilatoria (ver Tabla 1 de la referencia 71). Estos métodos, tanto como el método de la pendiente-V para determinar el UA son efectivos en sujetos con un patrón respiratorio razonablemente regular y que no tengan mecanismos respiratorios, o control ventilatorio perjudicados. Respetando estas últimas condiciones, se observó que el método de la pendiente-V es más confiable (37, 64).
Mecanismo III
La elevación de la ventilación, como resultado de la hiperventilación en respuesta al ejercicio (mecanismo III) acompañada por una caída de Pa CO2, y el aumento de la pendiente de VE versus VO2, podrían ser confundidos con el UA. Sin embargo, con tests de ejercicio progresivo de tipo-rampa o de incrementos cada 1 minuto, la principal elevación ocurre por encima del UA, donde está altamente influenciada por la compensación respiratoria para la acidosis metabólica.
CRITICA A LOS METODOS DE INTERCAMBIO GASEOSO
De acuerdo al método de intercambio gaseoso utilizado, existen problemas de distinto nivel en la determinación del UA. Utilizando los equivalentes ventilatorios para O2 y CO2 (VE/VO2 y VE/VCO2) (mecanismo II), hemos observado en un estudio (37) que los investigadores no pudieron ponerse de acuerdo sobre el umbral anaeróbico en el 40% de los sujetos. Las causas fueron patrones irregulares de respiración o fallas del sujeto para regular bien el Pa CO2 (la persona desarrollaba acidosis respiratoria leve). Además, el método de equivalente ventilatorio en general no es efectivo en sujetos que tienen limitaciones mecánicas en la respiración, ya que usualmente son incapaces de aumentar la tasa VE/VO2 por encima del UA y pueden retener CO2. Sin embargo, como muestra Sue y cols. (64), el método visual de la pendiente-V funciona bastante bien con estos pacientes. Para los sujetos normales, aquellas técnicas que se apoyan en los gráficos de ventilación vs. VO2 para buscar un punto de ruptura en la curva, parecen estar destinadas a estimar un valor de UA que es demasiado elevado, debido a que el aumento del flujo ventilatorio asociado con la compensación respiratoria para la acidosis metabólica, tiende a ser mayor que el aumento del flujo ventilatorio que acompaña al período de buffering isocápnico. Además, en general VE no es una función lineal del VO2, durante los tests de aumentos progresivos de cargas de trabajo. Esta sobreestimación ocurre especialmente con los métodos computarizados, tal como el descripto por Orr y cols. (72), el cual puede no percibir los cambios más sutiles del punto de ruptura de la relación VE versus VO2 y elegir, en cambio, el incremento de VE más prominente en el punto de compensación respiratoria. A medida que se aceleran los incrementos en la tasa de esfuerzo, se eleva la pendiente del segundo componente lineal del gráfico VCO2 vs. VO2 (análisis de la pendiente-V), como se muestra en la Figura 13. Además, para detectar un claro punto de ruptura en la relación VCO2-VO2 que represente el comienzo del tamponamiento de lactato por el HCO3-, la tasa de incremento de esfuerzo debería ser lo suficientemente rápida para causar un aumento significativo de lactato durante un test de ejercicios progresivos. En general, este es el caso de los protocolos con incrementos cada 1 minuto, si el aumento en sí es lo suficientemente grande para causar que el sujeto alcance su máximo rendimiento en 8-12 minutos (73). Si el UA del paciente no se ha logrado con el esfuerzo máximo, o si la tasa de incremento no es tan grande como para producir una cantidad de CO2 que se pueda medir, el componente superior de la curva (buffering o tamponamiento) (pendiente>1) no será evidente. En pacientes con enfermedades cardíacas, no sólo es posible que el UA sea reducido, sino que el segundo componente lineal del gráfico de la pendiente-V quizás sea más elevado que en personas normales. Esto se debe a una tasa de aumento de lactato y VCO2 más rápida y a una disminución en la tasa de aumento de VO2, a medida que progrese el esfuerzo (74). La Figura 16 muestra los datos del intercambio gaseoso de un paciente que muestra signos de isquemia de miocardio al llegar a su UA, signos que son más pronunciados a medida que progrese la tasa de esfuerzo. Este paciente no experimentó molestias en el pecho. Debido a que el VCO2 continuó aumentando y la tasa de aumento del VO2 se hacía más lenta, la relación VCO2-VO2 por encima del UA era anormalmente elevada (Figura 16). Estas irregularidades en el intercambio gaseoso reflejan los cambios funcionales en la capacidad de la circulación de transportar O2, luego de que el trabajo cardíaco fuera lo suficientemente grande como para provocar isquemia de miocardio.
EFECTO DEL UMBRAL ANAEROBICO SOBRE LAS RESPUESTAS FISIOLOGICAS AL EJERCICIO
Por encima de la tasa de UA ocurren cambios fisiológicamente importantes. Estos cambios incluyen: 1) acidosis metabólica (3); 2) alteración en la relación entre el VCO2 y el VO2 (37); 3) respuesta ventilatoria no lineal al incremento en la tasa metabólica (3); 4) alteración en la cinética del consumo de O2 (75); 5) cambios en el espectro electromiográfico de frecuencia del músculo en ejercicio (76); 6) aceleración de la reversibilidad de la glucosa (77, 78); y 7) incapacidad para realizar trabajos de resistencia (49). Estas marcadas alteraciones en las respuestas para los trabajos realizados por sobre el UA (acidosis láctica) reflejan su importancia fisiológica. Por lo tanto, las investigaciones sobre los mecanismos de control fisiológico que involucren al metabolismo, intercambio gaseoso, y control de la respiración durante el ejercicio, deberían tener en cuenta las cargas de esfuerzo realizadas a nivel del UA.
CONCLUSION
El UA, o umbral de acidosis láctica, representa una demarcación funcional de las tasas de esfuerzo que pueden ser mantenidas en un steady state (estado de equilibrio) durante largos períodos de tiempo, y de aquellas que son intensas y conducen a la acidosis metabólica, al incremento del flujo ventilatorio, y a la fatiga rápida. Por lo tanto, la precisión en su determinación puede brindar informaciones importantes acerca de la capacidad del transporte de O2 a los músculos esqueléticos que realizan ejercicios, y puede ser un índice objetivo de los cambios en la tolerancia al esfuerzo inducidos por el entrenamiento, la medicación, y otras intervenciones. Nosotros observamos que el aumento de lactato (y los cambios asociados en las respuestas fisiológicas) representa un fenómeno de umbral, y que el peso de la evidencia científica apoya la idea de la anaerobiosis como su mecanismo.
RECONOCIMIENTOS
Los autores agradecen a Barbara Young por su experto trabajo como secretaria en la preparación de este manuscrito. También quieren agradecer al Dr. James A. Davis por la cuidadosa revisión del mismo.
Referencias
1. Harrison TR, Pilcher C (1930). Studies in congestive heart failure. The respiratory exchange during and after exercise. J Clin Invest; 8: 291-315
2. Pilcher C, Clark G, Harrison TR (1929). Studies in congestive heart failure. III. The buffering power of the blood and tissues. J Clin Invest; 8: 317-323
3. Wasserman K, Whipp BJ (1975). Exercise physiology in health and disease. Am Rev Respir Dis; 112: 219-249
4. Siskind SJ, Sonnenblick EM, Forman R, Schuer J, LeJemtel TH (1980). Acute substantial benefit of inotropic therapy with amrinone on exercise hemodynamics and metabolism in severe congestive heart failure. Circulation; 64: 966-973
5. Weber KT, Janicki JS (1985). Lactate production during maximal and submaximal exercise in patients with chronic heart failure. J Am Coll Cardiol; 6: 717-724
6. Matsumura N, Nishijima H, Kojima S, Hashimoto F, Minami M, Yasuda H (1983). Determinations of anaerobic threshold for assessment of function state in patients with chronic heart failure. Circulation; 68: 360-367
7. Opasich C, Cobelli F, Riccardi G, Aquilani R, DeMartini A, Specchia G (1986). Applicability of the anaerobic threshold in patients with previous myocardial infarction. Adv Cardiol; 35: 100-107
8. Lipkin DP, Perrins J, Poole PA (1985). Respiratory gas exchange in the assessment of patients with impaired ventricular function. Br Heart J; 54: 321-32
9. Simonton CA, Higginbotham MB, Cobb F (1988). The ventilatory threshold: Quantitative analysis of reproducibility and relation to arterial lactate concentration in normal subjects and in patients with chronic congestive heart failure. Am J Cardiol; 62: 100-107
10. Hill AV, Long CNH, Lupton H (1924). Muscular exercise, lactic acid, and the supply and utilization of oxygen. VI. The oxygen debt at the end of exercise. Proc R Soc Lond; 97: 127-137
11. Barr DP, Himwich HE (1923). Studies in the physiology of muscular exercise: Development and duration of changes in acid-base equilibrium. J Biol Chem; 58: 539-555
12. Bock AV, Bill DB, Hurxthal LM, Lawrence JS, Coolidge TC, Dailey ME, Henderson LJ (1927). Blood gas as a physiochemical system: V. The composition and respiratory exchange of normal human blood during work. J Biol Chem; 73: 749-766
13. Owles WH (1930). Alterations in the lactic acid content of the blood as a result of light exercise, and associated changes in the CO2-combining power of the blood and in the alveolar CO2 pressure. J Physiol; 69: 214-237
14. Bouyhus A, Pool J, Binkhorst RA, vanLeeuwen P (1966). Metabolic acidosis of exercise in healthy males. J Appl Physiol; 21: 1040-1046
15. Holmgren A, McIlroy MB (1964). Effect of temperature on arterial blood gas tensions and pH during exercise. J Appl Physiol; 19: 243-245
16. Scherrer M (1969). Acid-base intolerance and gas exchange during heavy work. Biochem Exerc Med Sport; 3: 2-14
17. Wasserman K, VanKessel ML, Burton GG (1967). Interaction of physiological mechanisms during exercise. J Appl Physiol; 22: 71-85
18. Barr PO, Beckman M, Bjurstedt H, Brismar J, Hesser C, Matell G (1964). Time courses of blood gas changes provoked by light and moderate exercise in man. Acta Physiol Scand; 60: 1-17
19. Dempsey JA, Vidruk EH, Mastenbrook SM (1980). Pulmonary control systems in exercise. Fed Proc; 39: 1498-1505
20. Margaria R, Edwards HT, Dill DB (1933). The possible mechanisms of contracting and paying the oxygen debt and the role of lactic acid in muscular contraction. Am J Physiol; 106: 689-715
21. Naimark A, Wasserman K, McIlroy MB (1964). Continuous measurement of ventilatory exchange ratio during exercise. J Appl Physiol; 19: 644-652
22. Robinson S, Harmon PM (1941). The lactic acid mechanism and certain properties of blood in relation to training. Am J Physiol; 132: 757-769
23. Casaburi R, Storer TW, Ben-Dov I, Wasserman K (1987). Effect of endurance training on possible determinants of VO2 during heavy exercise. J Appl Physiol; 62: 199-207
24. Ceretelli P, Pendergast D, Paganelli WC, Rennie DW (1979). Effect of specific muscle training on VO2 on response and early blood lactate. J Appl Physiol; 47: 761-769
25. Aimers A, Jones NL, Lal (1965). The effect of hypoxia on gas exchange and arterial lactate and pyruvate concentration during moderate exercise in man. Clin Sci; 28: 1-13
26. Neill WA, Jensen PE, Rich GB, Wenschkul JD (1969). Effect of decreased O2 supply to tissue on the lactate/pyruvate ratio in blood. J Clin Invest; 48: 1862-1869
27. Miller TJ, Serjeant GR, Sicapragasam S, Petch MC (1973). Cardiopulmonary responses and gas exchange during exercise in adult with homozygous sickle-cell disease (sickle-cell anemia). Clin Sci; 44: 113-128
28. Woodson RD, Wills RE, Lenfant C (1978). Effect of acute and established anemia on O2 transport at rest, submaximal and maximal work. J Appl Physiol; 44: 36-43
29. Edwards HT (1936). Lactic acid in rest and work at high altitudes. Am J Physiol; 116: 367-375
30. Linnarsson D, Karlsson J, Fagraeus L, Saltin B (1974). Muscle metabolites and oxygen deficit with exercise in hypoxia and hyperoxia. J Appl Physiol; 36: 399-402
31. Lundin G, Strom G (1947). The concentration of blood lactic acid in man during muscular work in relation to the partial pressure of oxygen of the inspired air. Acta Physiol Scand; 13: 253-266
32. Tirnay S, Duardin J, Deroanne R, Petit JM (1971). Muscular exercise during intoxication by carbon monoxide. J Appl Physiol; 31: 573-575
33. Vogel JA, Gleser MA (1972). Effect of carbon monoxide on oxygen transport during exercise. J Appl Physiol; 32: 234-239
34. Banister EW, Taunton JE, Patrick T, Oforsagd P, Duncan WR (1970). Effect of oxygen at high pressure at rest and during severe exercise. Respir Physiol; 10: 74-84
35. Wasserman K, McIlroy MB (1964). Detecting the threshold of anaerobic metabolism in cardiac patients during exercise. Am J Cardiol; 14: 844-852
36. Wasserman K, Whipp BJ, Koyal SN, Beaver WL (1973). Anaerobic threshold and respiratory gas exchange during exercise. J Appl Physiol; 35: 236-243
37. Beaver WL, Wasserman K, Whipp BJ (1986). A new method for detecting the anaerobic threshold by gas exchange. J Appl Physiol; 60: 2020-2027v
38. Bylund-Fellenius AC, Walker PM, Elander A, Holm S, Holm J, Schersten T (1981). Energy metabolism in relation to oxygen partial pressure in human skeletal muscle during exercise. Biochem J; 200: 247-255
39. Sahlin K (1983). NADH/NADPH in human skeletal muscle at rest and during ischemia. Clin Physiol; 3: 477-485
40. Katz A, Sahlin K (1988). Regulation of lactic acid production during exercise. J Appl Physiol; 65: 509-518
41. Brooks GA (1985). Anaerobic threshold: Review of the concept and directions for future research. Med Sci Sports Exerc; 17: 22-31
42. Connett RJ, Gayeski TEJ, Honig CR (1986). Lactate efflux is unrelated to intracellular PO2 in a working red muscle in situ. J Appl Physiol; 61: 402-407
43. Holloszy JO (1973). Biochemical adaptations to exercise: Aerobic metabolism. In Wilmore JH (ed): Exercise and Sports Sciences Review. New York, Academic Press, vol 1, pp 45-71
44. Hughson RH, Weisigr KW, Swanson GD (1987). Blood lactate concentration increases as a continuous function in progressive exercise. J Appl Physiol; 62: 1975-1981
45. Sullivan MJ, Higginbotham MB, Cobb FR (1989). Exercise training in patients with chronic heart failure delays ventilatory anaerobic threshold and improves submaximal exercise performance. Circulation; 79: 324-329
46. Jobsis FF (1964). Basic processes in cellular respiration. In Fenn WO, Rahn H (eds): Handbook of Physiology Respiratory, Volume 1. Washington, DC, American Physiological Society, pp 104-107
47. Saltin B, Nazar K, Costill DL, Stein E, Jansson E, Essen B, Gollnick PD (1976). The nature of the training responses, peripheral and central adaptations to one-legged exercise. Acta Physiol Scand; 96: 289-305
48. Ivy JL, Withers RT, Van Handel PJ, Elger DH, Costill DL (1980). Muscle respiratory capacity and fiber type as determinants of the lactate threshold. J Appl Physiol; 48: 523-527
49. Wasserman K (1984). The anaerobic threshold measurement to evaluate exercise performance. Am Rev Respir Dis; 129: S 35-S 40
50. Beaver WL, Wasserman K, Whipp BJ (1985). Improved detection of lactate threshold during exercise using a log-log transformation. J Appl Physiol; 59: 1936-1940
51. Wasserman K, Beaver WL, Davis JA, Pu JZ, Heber D, Whipp BJ (1985). Lactate, pyruvate, and lactate-to-pyruvate ratio during exercise and recovery. J Appl Physiol; 59: 935-940
52. Yoshida T, Nagata A, Muro M, Takeuchi M, Suda Y (1981). The validity of anaerobic threshold determination by a Douglas bag method compared with arterial blood lactate concentration. Eur J Appl Physiol; 46: 423-430
53. Jorfeldt LA, Juhlin-Dannfelt A, Karlsson J (1978). Lactate release in relation to tissue lactate in human skeletal muscle during exercise. J Appl Physiol; 44: 350-352
54. Knottier HG, Saltin B (1972). Muscle metabolites and oxygen uptake in short-term submaximal exercise in man. J Appl Physiol; 32: 690-694
55. Lindholm A, Saltin B (1974). The physiological and biochemical responses of standardlined horses to exercise of varying speed and duration. Acta Vet Scand; 15: 310-324
56. Chwalbinska-Moneta J, Rogbergs RA, Costill DL, Fink WJ (1989). Threshold for muscle lactate accumulation during progressive exercise. J Appl Physiol; 66: 2710-2715
57. Yeh MP, Gardner RM, Adams TD, Yanowitz FG, Crapo RO (1983). Anaerobic threshold: Problems of determination and validation. J Appl Physiol; 55: 1178-1186
58. Radda GK (1986). The use of NMR spectroscopy for the understanding of disease. Science; 233: 640-645
59. Beaver WL, Lamarra N, Wasserman K (1981). Breath-by-breath measurement of true alveolar gas exchange. J Appl Physiol; 51: 1662-1675
60. Beaver WL, Wasserman K, Whipp BJ (1986). Bicarbonate buffering of lactic acid generated during exercise. J Appl Physiol; 60: 472-478
61. McLellan TM, Gass GC (1989). The relationship between ventilation and lactate thresholds following normal, low and high carbohydrate diets. Eur J Appl Physiol; 58: 568-576
62. Carraro F, Klein S, Rosenblatt JI, Wolfe RR (1989). Effect of dichloroacetate on lactate concentration in exercising humans. J Appl Physiol; 66: 591-597
63. Whipp BJ, Mahler M (1980). Dynamics of gas exchange during exercise. In West JB (ed): Pulmonary Gas Exchange. New York, Academic Press, vol 2, pp 36-96
64. Sue DY, Wasserman K, Morrica RB, Casabury R (1988). Measurement of anaerobic threshold by V-slope method in patients with chronic obstructive lung disease and normal subjects. Chest; 94: 931-938
65. Green HJ, Hughson RL, Orr GW, Ranney DA (1983). Anaerobic threshold, blood lactate, and muscle metabolites in progressive exercise. J Appl Physiol; 54: 1032-1038
66. Andersen P, Saltin B (1985). Maximal perfusion of skeletal muscle in man. J Physiol; 366: 233-249
67. Clausen JP (1976). Circulatory adjustments to dynamic exercise and effect of physical training in normal subjects and patients with coronary artery disease. Prog Cardiovasc Dis; 13: 459-495
68. Sullivan MJ, Higginbotham MB, Cobb FR (1989). Relationship between central and peripheral hemodynamics during exercise in patients with chronic heart failure: Muscle blood flow is reduced with maintenance of arterial perfusion pressure. Circulation (in press)
69. Wasserman K (1987). Determinants and detection of anaerobic threshold and consequences of exercise above it. Circulation; 76 (Suppl VI): VI- 29- VI-39
70. Hagberg JM, Coyle EF, Carroll JE, Miller JM, Martin WH, Brooke MH (1982). Exercise hyperventilation in patients with McArdless disease. J Appl Physiol; 52: 991-994
71. Whipp BJ, Ward SA, Wasserman K (1986). Respiratory markers of the anaerobic threshold. Adv Cardiol; 35: 47-64
72. Orr GW, Green HJ, Hughson RL, Bennett GW (1982). A computer linear regression model to determine ventilatory anaerobic threshold. J Appl Physiol; 52: 1349-1352
73. Wasserman K, Hansen JE, Sue DY, Whipp BJ (1987). Principles of Exercise Testing and Interpretation. Philadelphia, Lea & Febiger, pp 2, 7, 34, 63-64
74. Hansen JE, Sue DY, Oren A, Wasserman K (1987). Relation of oxygen uptake to work rate in normal men and men with circulatory disorders. Am J Cardiol; 59: 669-674
75. Whipp BJ, Wasserman K (1972). Oxygen uptake kinetics for various intensities of constant load work. J Appl Physiol; 33: 351-356
76. DeVries HA, Moritani T, Nagata A, Magnussen JK (1982). The relation between critical power and neuromuscular fatigue as estimated from electromyelographic data. Ergonomics; 25: 783-791
77. Idstrom JP, Harihara Subramanian V, Chance B, Schersten T, Bylund-Fellenius AC (1985). Oxygen dependence of energy metabolism in contracting and recovering rat skeletal muscle. Am J Physiol; 248 (Heart Circ Physiol 17): H 40-H 48
78. Cooper DM, Wasserman DH, Vranic M, Wasserman K (1986). Glucose turnover in responses to exercise during high and low FIO2 breathing in man. Am J Physiol; 251 (Endocrinol Metab 14): E 209-E 214