Utilización de Sustratos Musculares y Producción de Lactato durante el Entrenamiento de Sobrecarga
Duncan Mac Dougall1, R. Slavko1, Digby Sale1, N. Mac Cartney1, P. Lee1 y S. Garner1
Canadian Society for Exercise Physiology.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 2 de mayo de 2001
INTRODUCCIÓN
Una típica sesión de ejercicio para muchos atletas involucra un entrenamiento de sobrecarga de alta intensidad que incluye 3 o mas series de un ejercicio hasta el fallo muscular con una intensidad aproximada del 80 % de 1 R.M. A esta intensidad, un individuo puede realizar aproximadamente 12 reps. En la primera serie, 9-10 en la segunda serie, 7-8 en la tercera serie y así sucesivamente (Sale & MacDougall 81´).
Los mecanismos que producen fatiga muscular luego de una serie ejercicio son pobremente conocidos y pueden involucrar una disminución de la conducción nerviosa (Bigland & Ritchie 78´), una falla en los sitios de excitación - contracción (Bigland & Ritchie 74´ - Enoka & Stuart 92´) o ciertas consecuencias metabólicas como el descenso de PC muscular o el incremento de lactato y el PH (Chasiotis 83´- Hirvonen 87´- Hultman 90´- Spriet 87´).
Como estos ejercicios dependen de una máxima o casi máxima producción de ATP, desde la hidrólisis de la PC y de la glucólisis, el presente estudio intenta comprender y evaluar la posible contribución de la depleción de PC y del incremento del lactato muscular (H+) como la causa de la fatiga durante los ejercicios de sobrecarga.
Sin embargo la depleción de glucógeno y la producción de lactato han sido examinadas utilizando 3 y 6 series de extensiones de piernas (Rogers 91´), 9 series de extensiones concéntricas de piernas (Pascoe 93´), o 20 series de varios ejercicios de extensiones de piernas (Tesh 86´). Para nuestro conocimiento no existen investigaciones sobre la utilización de substratos o de producción de lactato utilizando una sola serie de entrenamiento de sobrecarga.
Consecuentemente nuestro propósito fue investigar la hidrólisis de PC, la glucogenólisis y la producción de lactato durante una sola serie de curl de bíceps al 80 % de 1 R.M luego de 3 series, en sujetos con experiencia en el entrenamiento se sobrecarga.
MÉTODOS
Ocho saludables varones con años experiencia en entrenamiento de sobrecarga (5 ± 1 año) fueron voluntarios para el estudio. El promedio y los desvíos estándar de la edad, la talla, y el peso fueron 24 ± 2 años, 178 ± 4 cm y 79 ± 7 kg respectivamente. Luego de la explicación del estudio y de sus posibles riesgos se obtuvo el consentimiento escrito de los voluntarios. El estudio fue aprobado por el Comité de ética de la universidad de McMaster.
Se midió la fuerza máxima (1 R.M) de la flexión de codo (curl de bíceps) en un solo brazo en un banco con amarre. Se utilizaron cargas libres y se tomo el mejor valor con dos kilos de aproximación. Los sujetos estaban amarrados en la posición de sentados y todos fueron evaluados en su brazo dominante. Luego de 30 minutos de recuperación se les pidió que realizaran la mayor cantidad de repeticiones hasta el agotamiento al 80 % de 1 R.M. Con esta intensidad todos los sujetos pudieron completar entre 11 y 13 repeticiones. Las repeticiones parciales no se tuvieron en cuenta.
Luego de 4 a 6 días y sin ningún entrenamiento de brazos de por medio, se dividió a los sujetos en dos grupos (A y B) con un n=4. Se tomaron biopsias musculares en reposo. El grupo A realizo una serie al 80 % de la R.M hasta el agotamiento. Los sujetos recibieron estímulos verbales durante la evaluación. Se tomo otra biopsia muscular luego de terminada la serie y la misma se congelo inmediatamente. Se realizo el mismo procedimiento para el grupo B pero los sujetos realizaron 3 series hasta el agotamiento con 3 minutos de pausa entre series. En ambos grupos de tomaron muestras de sangre por punción de uno de los dedos antes y 5 minutos luego de realizado el ejercicio para analizar la concentración de lactato (analizador de lactato YSI - OH).
Las biopsias se guardaron el nitrógeno liquido hasta su análisis. Se extrajo la grasa, la sangre y el tejido conectivo visible de las muestras y se congelaron nuevamente para luego ser pesadas. Se introdujeron en tubos de ensayos con 1.5 M de ácido percloridico, se dejaron reposar durante 30 minutos y se centrifugaron a 4° C. El sobrenadante se neutralizó a un PH de 7.0 con 2.3 M KCO3 y se centrifugo nuevamente. Se analizo la concentración de ATP, PC, LACTATO y GLUCOGENO del extracto neutralizado con una técnica enzimática fluorescente. (Bergmeyer 65´; Lowry & Passoneau 72´). Las concentraciones de los metabolitos fue expresada en mmol/kg de tejido seco.
Se realizo ANOVA de doble sentido y las diferencias se analizaron vis test de Tuckey post hoc. Las diferencias entre pre y post ejercicio de concentración de lactato fueron analizadas via test de Student con una significancia de p<0.05.
RESULTADOS
El grupo A completo un promedio de 12.0 ± 4 repeticiones en su serie y empleo un tiempo de 37 ± 3 segundos. El grupo B completo 11.7 ± 2 en la primera serie con 36 segundos, 9.2 ± 2 en la segunda serie con 33 segundos y 7.2 ± 1 en la tercera utilizando 27 segundos. El tiempo total de ejercicio fue de 96 ± 17 segundos. El tiempo promedio entre la finalización del ejercicio y el congelamiento de las biopsias fue de 17 ± 5 segundos.
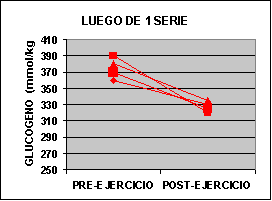
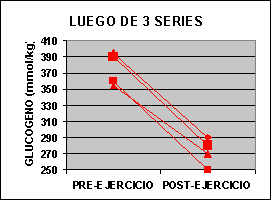
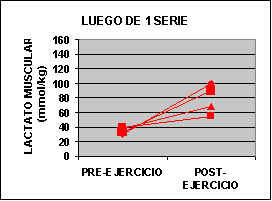
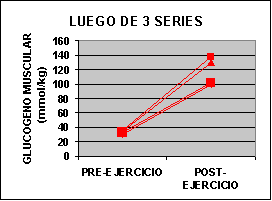
Las concentraciones individuales de ATP y PC se muestran en la figura 1 y las concentraciones de GLICÓGENO y LACTATO en la figura 2.
La concertación de ATP fue levemente mas baja en ambos grupos al finalizar el ejercicio aunque no fue significativo. La concentración de PC fue significativamente mas baja en el grupo A con un valor de 62% y para el grupo B 50% comparado con los valores de preejercicio. Luego de una serie de sobrecarga la concentración de glucógeno muscular se redujo en un 12 % en el grupo A pero si ser significativa. En el grupo B la baja fue de 24 % p<0.05. El lactato muscular se incrementó significativamente desde 7.3 a 91.4 mmol/kg. Pero luego de 3 series la concentración subió de 6.2 a 118 mmol/kg. Por otro lado, la única diferencia que se encontró entre los grupos fue la concentración de glucógeno luego del ejercicio.
El lactato sanguíneo se incremento significativamente desde 1.7 ± 0.8 a 3.5 ± 0.7 mmol/L luego de una serie y de 1.7 ± 0.7 a 4.7 ± 0.8 mmol/L luego de 3 series.
DISCUSIÓN
Los datos confirman que cuando sujetos con experiencia en sobrecarga realizan ejercicios con sobrecarga utilizando una fase concéntrica y excéntrica al 80 % de 1 R.M, se fatigan aproximadamente a las 12 repeticiones. Esta fatiga es acumulativa y en consecuencia hay un descenso del numero de repeticiones luego de cada serie subsecuente utilizando 3 minutos de recuperación entre series.
La concentración de ATP muscular no se redujo al punto de la fatiga en ningún grupo y es consistente con un numero de estudios los cuales han verificado que el músculo esquelético es capaz de preservar su contenido de ATP durante el ejercicio intenso hasta la fatiga. (Fitts 94´- Fitts & Holloszy 76´- Neville 89´). Además en el presente estudio la fatiga se considero cuando el sujeto no podía realizar una repetición mas con una 20 % de descenso (80% R.M.). Por eso no se puede considerar que el músculo este exhausto.
El 62 % de descenso de la PC luego de una serie es similar al encontrado por Cheethan 86´ luego de 30 segundos de sprint máximos en un treadmill. Como en nuestro estudio no se ocluyo la circulación en el brazo luego de realizar el ejercicio, es muy posible que se regenerara una significativa cantidad de ATP y PC luego de haber terminado la ultima repetición hasta la toma de la biopsia muscular. (Harris 76´- Sahlin 98´). De este modo es probable que al punto de la fatiga las concentraciones de fosfagenos fueran inferiores a las halladas y resultaran la causa de la fatiga muscular. Nuestros resultados muestran que no hubo diferencia en las concentraciones de PC luego de hacer 1 o 3 series de sobrecarga por lo que creemos que 3 minutos de pausa es suficiente para restaurar los depósitos (Harris 76´- Sahlin 98´). La fatiga acumulada cuando progresaban las series no fue probablemente la depleción de la PC ya que tendía a ser superior luego de realizar las 3 series (grupo B).
Sin embargo la concentración de lactato sanguínea se incremento de 3 a 4 veces luego del ejercicio, aunque los valores son inferiores a los encontrados en 30 segundos de ciclismo hasta el agotamiento (Bogdanis 96´- McCartney 86´). Creemos que las diferencia están relacionadas con la cantidad de masa muscular utilizada en cada ejercicio. Las concentraciones de lactato muscular luego de una serie fueron inferiores a las encontradas en luego de un típico Wingate test (110 - 135 mmol/kg - Bogdanis 96´- McCarteney 86´). Creemos que estas diferencia están relacionadas con el echo de que nosotros consideramos la fatiga a un 80 % de intensidad y en el Wingate test se obtiene al 60 % del máximo (Odland 97´). Durante el ejercicio al 80% de 1 R.M. se puede considerar que hay una oclusión completa de la circulación sanguínea por incremento de la presión intramuscular (Bonde - Petersen 75´) y de este modo poco a casi nada de lactato se puede escapar del músculo durante el ejercicio. Sin embargo existe un flujo de LACTATO hasta que se realiza la toma de la biopsia por lo que se puede intuir que los valores son superiores a los encontrados.
El 24 % de depleción de glucógeno encontrada luego de 3 series es similar a lo observado por Robergs 91´ luego de 3 series de extensiones de piernas al 70% de 1 R.M. En el presente estudio la tasa de glucogenólisis luego de una serie fue de 1.24 mmol/kg y de 0.96 mmol/kg luego de la tres series, sugiriendo un descenso de la tasa conforme aumentan las series. Algunos de estos hallazgos también han sido observados luego de series de 30 segundos de ejercicio en bicicleta (McCartney 86´) y puede ser atribuido al incremento de la inhibición producida por lo iones H+ sobre la glucogenólisis durante el ejercicio continuo (Chasiotis 83´).
Sin bien 3 minutos de pausa fue probablemente adecuado para la restitución de los depósitos de PC (Harris 76´- Sahlin 98´), fue poco para remover el lactato muscular (Bogdanis 96´). En consecuencia cada serie empezara con una concentración elevada de lactato y de H+.
Para mantener la producción de fuerza el músculo debe buscar mantener la concentración de ATP a expensas de la PC y de la glucogenólisis. De este modo la fatiga ocurriría por una depleción de los depósitos de PC muscular y por un descenso en la tasa de glucogenólisis. También es posible que la fatiga se produzca por una combinación de muchos factores. En este estudio nosotros elegimos el análisis de los fosfagenos y del H+. Reconocemos que otros factores contribuyen al descenso de la capacidad para generar fuerza. Es importante notar que nuestro estudio solo presenta valores promedio. Es posible que la cantidad de depleción de PC y la producción de lactato puede ser exagerada y la tasa de resíntesis de la PC baja en las fibras de tipo II (Soderlund & Hultman 91´). Se debe considerar que estas fibras son mas susceptibles a la fatiga a un mismo nivel de depleción de PC y de aumento de H+. (Sthepenson 98´). Se puede especular que estas fibras se fatigaron rápidamente y tuvieron un efecto sobre la capacidad para generar fuerza.
Creemos que la causa de la fatiga luego de realizar una serie de sobrecarga al 80% de intensidad fue probablemente la disminución de la PC y los efectos inhibidores del lactato muscular (H+). Con series subsecuentes la fatiga se puede deber principalmente a un incremento del H+ muscular. En conclusión aparentemente la mayor vía de aporte energético durante los ejercicios de sobrecarga es la glucogenólisis y que se pueden encontrar valores de descanso significativos luego de una pocas series al 80 % de una R.M.
Referencias
1. Bergmeyer, H.U. (1965). Methods of Enzymatic Analysis. New York: Academic Press
2. Bigland-Ritchie, B (1984). Muscle fatigue and the influence of changing neural drive. Clin. Chest Med. 5: 21-34
3. Bigland-Ritchie, B., Jones, D.A., Hosking, G.P., and Edwards, R.T.H (1978). Central and peripheral fatigue in sustained maximal voluntary contractions of human quadriceps muscle. Clin. Sci. Mol. Med. 54: 609-614
4. Bogdanis, G.C., Nevill, M.E., Boobis, L.H., and Lakomy, H.K.A (1996). Contribution of phosphocreatine and aerobic metabolism to energy supply during repeated sprint exercise. J. Appl. Physiol. 80: 876-884
5. Chasiotis, D., Hultman, E., and Sahlin, K (1983). Acidotic depression of cyclic AMP accumulation and phosphorylase b to a transformation in skeletal muscle in man. J. Physiol. Lond. 355: 197-204
6. Cheetham, M.E., Boobis, L.H., Brooks, S., and Williams, C (1986). Human muscle metabolism during sprint funning. J. Appl. Physiol. 61: 64-60
7. Enoka, R.M., and Stuart, D.G (1992). Neurobiology of muscle fatigue. J. Appl. Physiol. 72: 1631-1648
8. Fitts, R.H (1994). Cellular mechanisms of muscular fatigue. Physiol. Rev. 74: 49-94
9. Fitts, R.H., and Holloszy, J.O (1976). Lactate and contractile force in frog muscle during development of fatigye and recovery. J. Physiol. 231: 430-433
10. Harris, R.C., Edwards, R.H.T., Hultman, E., Nordesjo, L.D., Nylind, B., and Sahlin, K (1976). The time course of phosphorylcreatine resynthesis during recovery of the quadriceps muscle of man. Pflügers Arch. 367: 137-142
11. Lowry, H.O., and Passonneau, J.V (1972). A Flexible System of Enzyme Analysis. New York: Academic Press
12. McCartney, N., Spriet, L.L., Heigenhauser, G.J.F., Kowalchuk, J.M., Sutton, J.R., and Jones, N.L (1986). Muscle power and metabolism in maximal intermittent exercise. J. Appl. Physiol. 60: 1164-1169
13. Nevill, M.E., Boobis, L.H., Brooks, S., and Williams, C (1989). Effect of training on muscle metabolism during treadmill sprinting. J. Appl. Physiol. 67: 2376-2382
14. Odland, L.M., MacDougall, J.D., Tarnopolsky, M.A., Elorriaga, A., and Borgmann, A (1997). Effect of oral creatine supplementation on muscle [PCr] and short-tem maximum power output. Med. Sci. Sports Exerc. 29: 216-219
15. Pascoe, D.D., Costell, D.L., Fink, W.J., Robergs, R.A., and Zachwieja, J.J (1993). Glycogen resynthesis in skeletal muscle following resistive exercise. Med. Sci. Sports Exerc. 25: 349-354
16. Robergs, R.A., Pearson, D.R., Costill, D.L. Fink, W.J., Pascoe, D.D., Benadict, M.A., Lambert, C.P., and Zachwella. J.J (1991). Muscle glycogenlysis during different intensities of weight-resistance exercise. J. Appl. Physiol. 70: 1700-1706
17. Sale, D.G., and Mac Dougall, J.D (1981). Specificity in strength training; A review for the coach and athlete. Can. J. Appl. Sport Sci. 6: 87-91
18. Stephenson, D.G., Lamb, G.D., and Stephensono, G.M.M (1998). Events of the excitation-contraction-relaxation (E-C-R) cycle in fast -and slow- twitch mammatian muscle fibres relevant to muscle fatigue. Acta Physiol. Scand. 162: 229-245
19. Tesch, P.A., Colliander, B., and Kaiser, P (1986). Muscle metabolism during intense. heavy resistance exercise. Eur. J. Appl. Physiol. 55: 363-366