Biomarcadores Asociados con Hipertrofia Baja, Moderada y Alta del Músculo Vasto Lateral Después de 12 Semanas de Entrenamiento de la Fuerza
Christopher B. Mobley, Cody T. Haun, Paul A. Roberson, Petey W. Mumford, Wesley C. Kephart, Matthew A. Romero, Shelby C. Osburn, Christopher G. Vann, Kaelin C. Young, Darren T. Beck, Jeffrey S. Martin, Christopher M. Lockwood y Michael D. Roberts
Artículo publicado en el journal PubliCE del año 2018.
Publicado 6 de noviembre de 2018
Resumen
INTRODUCCIÓN
El entrenamiento de la fuerza es un potente estímulo para la hipertrofia de las fibras musculares esqueléticas. Los mecanismos bien conocidos asociados con esta respuesta adaptativa incluyen incrementos repetitivos post-ejercicio en la síntesis de proteínas musculares (MPS) [1], así como aumentos en la proliferación de células satélite y en la acumulación mionuclear [2]. Datos recientes [3,4] y comentarios [5,6] también han sugerido que la biogénesis de ribosoma es crítica para la hipertrofia muscular dado que los ribosomas catalizan la MPS. La biogénesis de ribosoma implica la acción coordinada de factores de transcripción y co-activadores transcripcionales [por ejemplo, v-Myc Mielocitomatosis aviar Viral Oncogen Homolog (c-Myc), Upstream Binding Factor (UBF), y otros] que reclutan ARN polimerasa I (Pol I) a regiones promotoras repetitivas de ADNr para facilitar la transcripción de pre-ARNr 47S [6,7]. Además, la transcripción de ADNr es aparentemente limitante en el proceso de biogénesis de ribosoma [8]. Existen pruebas que sugieren que el crecimiento de miofibras se suprime con la inhibición in vitro de Pol I [4], lo que subraya la importancia de la actividad de la Pol I para facilitar el crecimiento muscular. El proceso de biogénesis de ribosoma es también muy complejo, ya que implica la remodelación de la cromatina a través de complejos que contienen proteínas como la proteína de la región cromosómica 10 del síndrome de Williams-Beuren (WSTF, por sus siglas en inglés) y las proteínas de los miembros de la familia SWI/SNF [9]. Sin embargo, aparte de los estudios mencionados anteriormente, existe evidencia limitada que examine si varios marcadores de la biogénesis de ribosoma coinciden con la hipertrofia del músculo esquelético después del entrenamiento de la fuerza en humanos.
Estudios anteriores del grupo de Bamman han utilizado el Analisis Cluster k-medias para delinear las características moleculares entre respondedores hipertróficos bajos/no, moderados y altos al entrenamiento de la fuerza [4,10,11]. En particular, este enfoque estadístico ha sido ampliamente utilizado en los últimos 50 años y posee una gran utilidad dado que implementa un algoritmo sistemático e imparcial para clasificar los grupos de respuesta basados en una variable de criterio [12]. Usando este enfoque, Petrella et al. [10] informaron que los aumentos en los recuentos de células satélite inducidos por el entrenamiento de la fuerza fueron mayores en los individuos que experimentaban un incremento “extremo” en el área de sección transversal de la fibra muscular (fCSA, por sus siglas en inglés) al entrenamiento de la fuerza (llamados respondedores XTR) en comparación con los individuos que experimentaban una respuesta hipertrófica mínima al entrenamiento de la fuerza (denominados NO respondedores). Los análisis de seguimiento indicaron que los respondedores XTR experimentaron fuertes aumentos en la expresión ARNm de los genes relacionados con la señalización del factor de crecimiento y la actividad de las células satélite después de 16 semanas de entrenamiento de la fuerza (por ejemplo, diferentes variantes unidas del Factor de Crecimiento Semejante a la Insulina-1 y la Miogenina) [13]. Además, un interrogatorio a nivel del transcriptoma de estos mismos sujetos reveló que los ARNm relacionados con la biogénesis de ribosoma estaban regulados al alza mientras que los ARNm relacionados con la inflamación estaban regulados a la baja en los respondedores XTR versus los NO respondedores [11]. Dado que la inflamación intensificada puede aumentar la proteólisis muscular [14,15], la incapacidad de los respondedores bajos o no-hipertróficos para regular a la baja la inflamación durante el entrenamiento de la fuerza puede conducir a un estancamiento del crecimiento muscular. Más allá de estos datos del grupo de Bamman, Mitchell et al. [16] informaron que los aumentos en los niveles de proteína del receptor de andrógenos del músculo esquelético se correlacionaron con la hipertrofia de la fibra muscular después de 12 semanas de entrenamiento de la fuerza en humanos.
Recientemente publicamos una investigación con hombres en edad universitaria, no entrenados que probó los efectos anabólicos potenciales de la L-leucina o de la suplementación proteica durante 12 semanas de entrenamiento de la fuerza [17]. En este caso, adoptamos el enfoque Cluster K-medias similar al del laboratorio de Bamman [10], pero en lugar de grupos basados en cambios en la fCSA media, generamos tres grupos basados en cambios en el grosor del vasto lateral (VL) evaluado mediante ecografía e identificamos a los respondedores bajos (LOW), moderados (MOD) y altos (HI). En particular, el grosor de la ecografía del VL se utilizó como nuestra variable de criterio para la hipertrofia muscular, dado que el seguimiento de los cambios en el grosor muscular mediante ecografía puede ser más sensible que la absorciometría de rayos X de doble energía (DXA) para el seguimiento de los cambios en la masa corporal magra [18]. Además, mientras se deliberaba si usar los cambios en la fCSA como variable de grupo, el trabajo clásico de Lexell sugiere que el número de fibras musculares dentro del VL puede diferir apreciablemente sobre una base individual en hombres más jóvenes (intervalo de confianza de 95% calculado = 433.191 a 522.809 fibras) [19]. Como ejemplo conceptual, si dos individuos experimentan aumentos similares en el grosor del VL después del entrenamiento de la fuerza, se plantea que el individuo con más fibras musculares dentro del VL probablemente no experimente mayores aumentos absolutos en la fCSA en relación con el individuo con menos fibras a pesar del hecho de que el músculo VL se hipertrofió en un grado similar. Siguiendo nuestra agrupación de espesores de VL, buscamos examinar si los niveles de pre-entrenamiento o los cambios inducidos por el entrenamiento en las medidas de composición corporal junto con los recuentos totales de células satélite, los marcadores de biogénesis de ribosoma, los marcadores de señalización androgénica, o los marcadores inflamatorios y proteolíticos diferían entre los grupos. Se hipotetizó que los recuentos de células satélite, los marcadores de biogénesis de ribosoma y/o los marcadores de señalización androgénica serían mayores al comienzo o después del entrenamiento en los respondedores HI, en comparación con otros grupos, mientras que estas variables serían menores en el comienzo o estarían menos impactadas por el entrenamiento de la fuerza en los respondedores LOW o MOD. Además, se hipotetizó que los marcadores inflamatorios y de proteólisis serían mayores al comienzo o después del entrenamiento de la fuerza en los respondedores LOW en relación con los otros grupos.
MATERIALES Y MÉTODOS
Protocolo de estudio
Antes de iniciar este estudio, el protocolo fue revisado y aprobado por la Junta de Revisión Institucional de la Universidad de Auburn (IRB), y cumplió con la Declaración de Helsinki (protocolo aprobado #: 15-320 MR 1508; contacto del IRB: irbadmin@auburn.edu). Los participantes dieron su consentimiento por escrito y completaron un cuestionario de historia clínica para detectar factores de riesgo potenciales que podrían agravarse con actividad física extenuante o biopsias de músculo esquelético.
Los hombres sin entrenamiento (es decir, al menos 6 meses sin entrenamiento estructurado de fuerza), en edad universitaria (n = 67) de nuestro estudio previamente publicado [17] se clasificaron para los análisis en el estudio actual. Los participantes realizaron sesiones de entrenamiento de la fuerza de cuerpo entero tres días a la semana durante 12 semanas. Cada sesión de entrenamiento consistía en ejercicios con pesos libres (es decir, sentadilla con barra, press de banca con barra, peso muerto con barra y remo con barra) y crunch abdominal. Se empleó un modelo de periodización ondulante de ejercicios de fuerza que resultó en una hipertrofia muscular significativa y una mejora de la fuerza en hombres de edad universitaria [20]. El primer período de entrenamiento de cada semana consistió en que cada movimiento de barra se realizara durante 4 series de 10 repeticiones, el segundo período consistió en que cada movimiento se realizara durante 6 series de 4 repeticiones, y el tercero consistió en que cada movimiento se realizara durante 5 series de 6 repeticiones. Las cargas levantadas por cada movimiento de barra se incrementaron gradualmente por participante durante el transcurso del estudio, donde se empleó el ~50% de una repetición máxima estimada (1RM) para cada movimiento durante la semana 1 del estudio, con cargas que aumentaron a ~110% de las 1RM iniciales estimadas para el final del entrenamiento. En el caso de que una carga no pudiera ejecutarse con una técnica competente para un ejercicio en un período de entrenamiento dado, el peso se reducía por participante, por lo tanto, para que se pudiera ejecutar la siguiente serie. Los volúmenes de entrenamiento para todos los participantes se registraron a lo largo de todo el estudio.
Se tomaron muestras de sangre y de biopsia muscular de la vena antecubital y del músculo VL, respectivamente, y estas muestras se obtuvieron una semana antes del entrenamiento (PRE) y 72 horas después del último período de entrenamiento (POST) aproximadamente a la misma hora del día (± 2 horas) al menos 4 horas después de una comida. Durante estas sesiones de prueba, se tomaron medidas del grosor del VL mediante ecografía y se evaluó la masa corporal magra utilizando la absorciometría de rayos X de doble energía (DXA). También se realizaron pruebas de fuerza de 3RM de sentadilla PRE y POST de acuerdo con las recomendaciones de la Asociación Nacional de Acondicionamiento y Fuerza [21]. Los participantes completaron registros de alimentos de cuatro días antes de las visitas PRE y POST, y se analizó la ingesta de calorías y macronutrientes mediante un software de código abierto (https://www.myfitnesspal.com), que ha sido validado por investigaciones anteriores [22] y ha sido utilizado por otros que realizaron intervenciones de entrenamiento de la fuerza [23,24]. Los lectores se dirigen a Mobley et al. [17] para obtener descripciones más detalladas de las baterías de pruebas PRE y POST, así como del protocolo de entrenamiento. Además, todos los métodos relacionados con la composición corporal, análisis de suero y de tejidos se encuentran en la información de apoyo (S1 Archivo 1. Métodos analíticos).
ESTADÍSTICAS
Se utilizó el Analisis Cluster k-medias (SPSS v 22.0; IBM Corp.; Armonk, NY, USA) basado en los cambios en el grosor del VL tras el entrenamiento de la fuerza para identificar tres grupos, similar a los métodos de Stec et al. [4]. Después de la agrupación de k-medias, se realizó la prueba de normalidad de Shapiro-Wilk para todas las variables dependientes. Todas las variables para las cuales se observó la significación fueron transformadas de raíz cuadrada para las pruebas estadísticas subsiguientes (anotadas en los resultados). Dado que el grupo MOD tuvo más respondedores en relación con el grupo LOW y HI, la homogeneidad de las pruebas de varianza entre los grupos en PRE y POST se llevó a cabo en todas las variables dependientes utilizando las pruebas de Levene. En particular, todas las variables excepto la proteína Pol I en POST tenían valores p >0,05 del test de Levene. Por lo tanto, no se realizaron ajustes post hoc, dado que las varianzas entre los grupos eran estadísticamente similares en todas las variables menos en una. Se analizaron algunas variables dependientes al comienzo entre grupos utilizando el ANOVAs unidireccional con las pruebas post hoc de Tukey. Se analizaron las comparaciones de variables dependientes a lo largo del tiempo entre los grupos utilizando medidas repetidas factoriales mixtas ANOVAs de 3×2 (grupo×tiempo). Si se observaba un efecto de grupo significativo, se realizaban las pruebas post hoc de Tukey para determinar qué grupos diferían. Si se observaba una interacción grupo×tiempo significativa, se realizaban pruebas t de muestras dependientes de PRE a POST (corregidas para múltiples comparaciones) dentro de cada grupo, y se realizaban ANOVAs unidireccionales con pruebas post hoc de Tukey en los puntos de tiempo PRE y POST para determinar las diferencias entre grupos. También se realizaron correlaciones bivariadas en variables seleccionadas que diferían entre los grupos para establecer mejor el grado de asociación que existía entre los biomarcadores y el cambio en el grosor del VL. Todos los análisis estadísticos se realizaron utilizando SPSS v22.0 (IBM Corp) y la significación se estableció en p<0,05, aunque también se discutieron los valores p de "significación aproximada" (es decir, 0,050<p<0,100) dada la naturaleza exploratoria de la investigación. Todos los datos en bruto se pueden encontrar en la información de apoyo (Archivo S2. Datos en bruto).
RESULTADOS
Características de grupo basadas en los cambios de grosor del VL
Para referencia, la Fig. 1 ilustra los tres grupos basados en los cambios en el grosor del VL después de 12 semanas de entrenamiento de la fuerza. Los valores para cada uno de los grupos fueron los siguientes [media ± DE, (rango)]: LOW= 0,11 ± 0,14 cm (-0,28 a 0,25 cm), MOD = 0,40 ± 0,06 cm (0,29 a 0,52 cm), HI 0,69 ± 0,14 cm (0,59 a 1,20 cm).
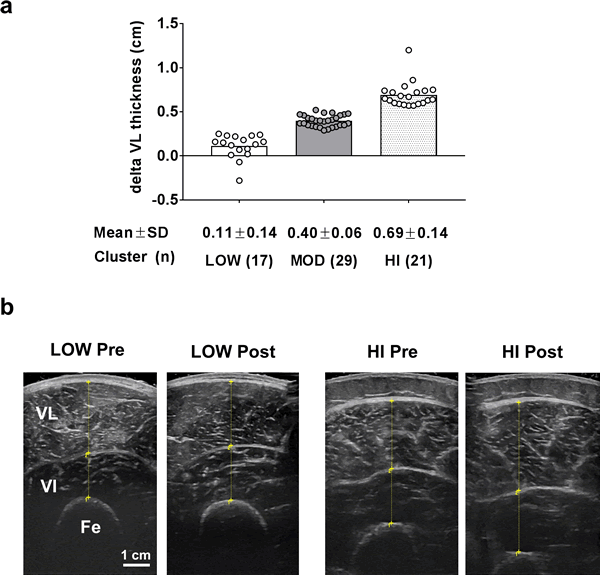
Figura 1. Espesor del VL como variable de agrupación.
Leyenda: Se utilizó el Analisis Cluster k-medias para diferenciar los respondedores LOW, MOD y HI (panel a). Los datos se presentan como valores individuales de respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra. El panel b muestra imágenes de ecografías representativas de PRE versus POST (barra de escala = 1 cm); abreviaturas: VL, vasto lateral; VI, vasto intermedio, Fe, fémur.
https://doi.org/10.1371/journal.pone.0195203.g001
Características iniciales y volumen total de entrenamiento entre grupos
Las diferencias pre-entrenamiento entre los grupos en cuanto a edad, masa corporal y tipo de fibra se presentan en la Tabla 1. El volumen total de entrenamiento registrado durante la intervención también se presenta en la Tabla 1. En particular, no hubo diferencias significativas entre los grupos en las variables iniciales examinadas o en el volumen total de entrenamiento a lo largo del estudio (rangos de valores p de ANOVA = 0,239-0,405). Como se indicó anteriormente, los participantes consumieron ya sea placebo de maltodextrina, L-leucina con maltodextrina (LEU) o diferentes suplementos proteicos [concentrado de proteína de suero (WPC), proteína de suero hidrolizada (WPH), concentrado de proteína de soja (SPC) o placebo de maltodextrina (PLA)] durante todo este estudio [17]. El valor p de Chi-cuadrado de la Tabla 1 ilustra que el número de participantes que representaban cada nivel de suplemento no difirió estadísticamente. Por lo tanto, el efecto del suplemento sobre el agrupamiento de los participantes probablemente no fue significativo.
Tabla 1. Características iniciales y volumen de entrenamiento entre grupos.
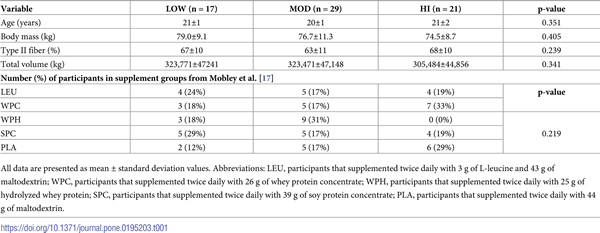
https://doi.org/10.1371/journal.pone.0195203.t001
Ingesta de macronutrientes autoinformada entre grupos
En la Tabla 2 se presentan las diferencias de ingesta de macronutrientes PRE y POST entre grupos. No hubo efectos de grupo o interacciones de grupo×tiempo para la ingesta diaria de calorías, proteínas, carbohidratos o grasas. Sin embargo, hubo efectos principales significativos de tiempo para todas estas variables (POST>PRE, p<0,001).
Tabla 2. Ingesta de macronutrientes autoinformada.
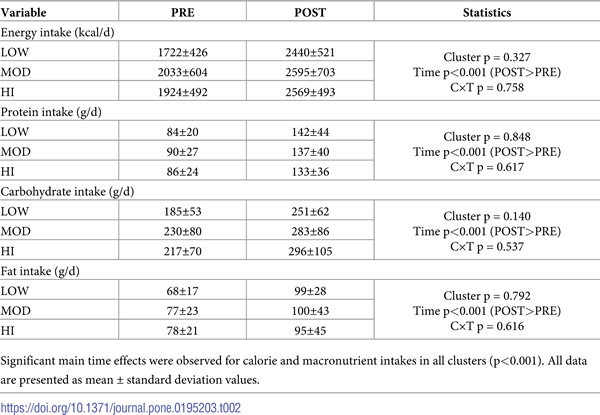
https://doi.org/10.1371/journal.pone.0195203.t002
Cambios pre- a post-entrenamiento en el grosor del VL y en la masa corporal magra de DXA
Se observó un efecto de tiempo significativo (POST>PRE, p<0,001) y una interacción grupo×tiempo (p<0,001) para el cambio en el espesor del VL (Fig. 2A). Todos los grupos experimentaron aumentos en el grosor del VL (p<0,05). Los valores PRE del espesor del VL fueron mayores en LOW versus HI (p = 0,014), mientras que los valores POST fueron mayores en HI versus LOW (p = 0,006). Sin embargo, sólo hubo una correlación débil entre las puntuaciones iniciales del espesor del VL y el cambio en los valores del espesor del VL (r2 = 0,114; p = 0,005). Se observó un efecto de tiempo significativo (POST>PRE, p<0,001) para los cambios de masa corporal magra de DXA (Fig. 2B), pero no existió ningún efecto de grupo o interacción de grupo×tiempo.
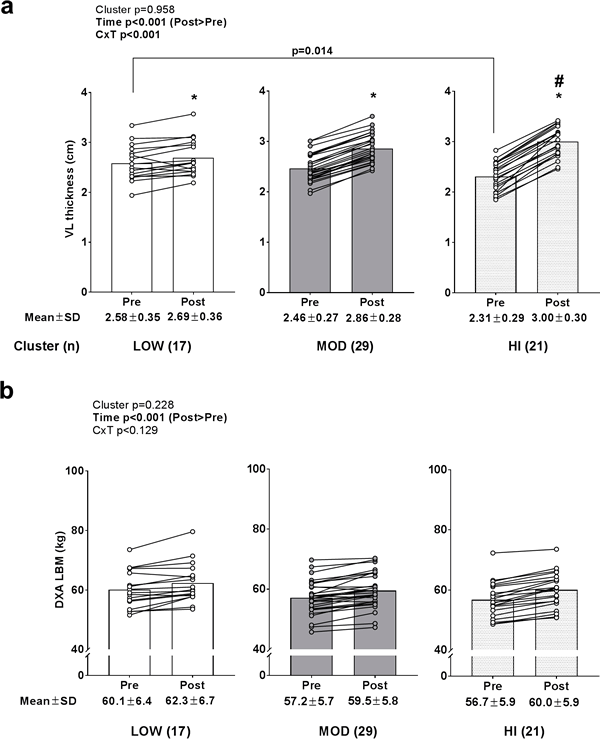
Figura 2. Grosor del VL pre- y post- entrenamiento y valores de masa corporal magra de DXA entre grupos.
Leyenda: Todos los grupos presentaron aumentos en el grosor del VL después del entrenamiento de la fuerza (*, p<0,05) (panel a), aunque los niveles PRE fueron mayores en LOW versus HI (p = 0,014) y los niveles POST fueron mayores en HI versus LOW (#, p = 0,006). El panel b muestra los cambios en la masa corporal magra (LBM) de DXA PRE- a POST-entrenamiento, donde sólo se observó un efecto de tiempo (p<0,001). Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g002
Cambios en el área de sección transversal de la fibra muscular, el número de mionúcleos y el número de células satélite entre grupos
Se observó un efecto de tiempo significativo (POST>PRE, p<0,001) y una interacción grupo×tiempo (p = 0,002) para el cambio en la fCSA tipo I (Fig. 3A). Los grupos LOW y HI experimentaron aumentos en la fCSA tipo I (p<0,05), aunque no hubo diferencias en los valores PRE o POST entre los grupos. También se observó un efecto de tiempo significativo (POST>PRE, p<0,001) y una interacción grupo×tiempo (p = 0,006) para el cambio en la fCSA tipo II (Fig. 3B). Los grupos LOW y HI experimentaron aumentos en la fCSA tipo II (p<0,05) y los aumentos en el grupo MOD se aproximaron a la significación (p = 0,086). Sin embargo, no hubo PRE o POST diferencias en los valores de la fCSA tipo II entre los grupos. Sólo se observaron efectos de tiempo significativos (POST>PRE, p<0,001) para el cambio en el número de mionúcleos de la fibra tipo I (Fig 3C), el número de mionúcleos de la fibra tipo II (Fig 3D) y el número de células satélite (datos transformados antes del análisis debido a una distribución no normal; Fig 3E).
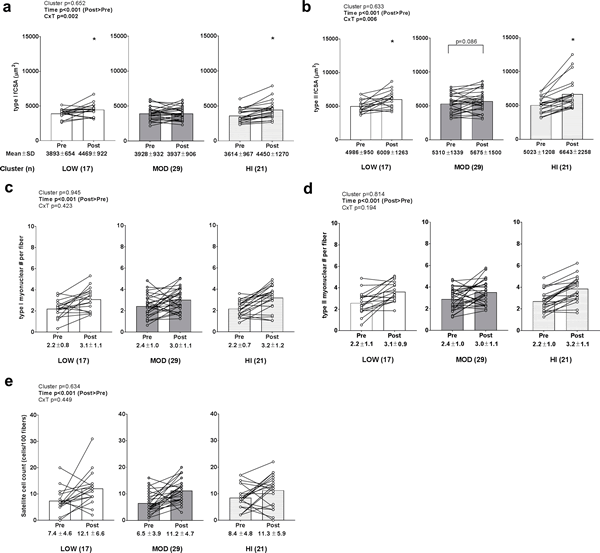
Figura 3. Cambios en el área de sección transversal de la fibra muscular, el número de mionúcleos y el número de células satélite entre grupos
Leyenda: Los principales efectos de tiempo existieron para los cambios de la fCSA tipo I (POST>PRE, p<0,001) (panel a), de la fCSA tipo II (POST>PRE, p<0,001) (panel b), número de mionúcleos por fibra tipo I (POST>PRE, p<0,001) (panel c), número de mionúcleos por fibra tipo II (POST>PRE, p<0,001) (panel d), y número de células satélite (POST>PRE, p<0,001) (panel e). Sin embargo, no existieron efectos de grupo o interacciones grupo×tiempo. Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g003
Cambios en los marcadores de biogénesis de ribosoma entre grupos
No existieron efectos principales ni interacciones grupo×tiempo para la proteína c-Myc (datos transformados antes del análisis debido a una distribución no normal), la proteína WSTF o los niveles de proteína ARN pol-I (Fig. 4A-4C). Los principales efectos de tiempo existieron para los niveles de ARNr 45S (datos transformados antes del análisis debido a una distribución no normal; PRE>POST, p = 0,002; Fig. 4D) y los niveles totales de ARN (datos transformados antes del análisis debido a una distribución no normal; POST>PRE, p<0,001; Fig. 4E), pero no existieron efectos principales de grupo ni interacciones de grupo×tiempo. Hubo una correlación débil pero significativa entre el cambio en el ARN total del músculo y el grosor del VL (r2 = 0,079; p = 0,026).
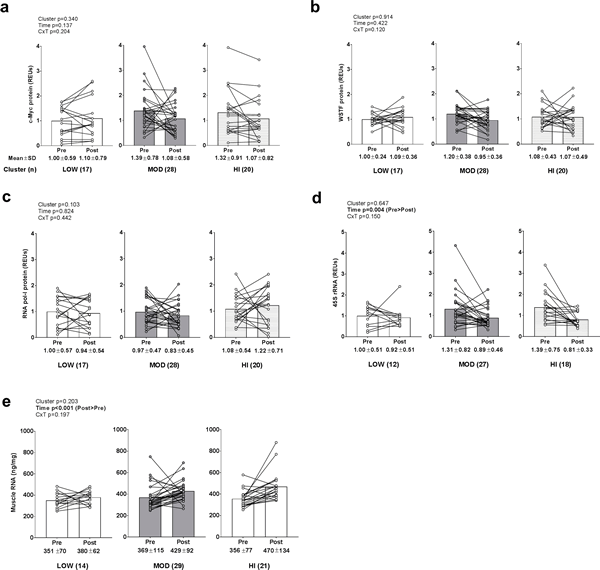
Figura 4. Alteraciones en los biomarcadores de biogénesis de ribosoma entre grupos.
Leyenda: No existieron efectos principales o interacciones grupo×tiempo para los niveles de proteína c-Myc (panel a), proteína WSTF (panel b), o proteína ARN pol-I (panel c). Los principales efectos de tiempo existieron para los niveles de ARNr 45S (PRE>POST, p = 0,004) (panel d) y los niveles totales de ARN (POST>PRE, p<0,001) (panel e), pero no existieron efectos principales de grupos o interacciones grupo×tiempo. Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g004
Biomarcadores de señalización androgénica entre grupos
No existieron efectos principales significativos ni interacción grupo×tiempo para la testosterona total en suero (datos transformados antes del análisis debido a una distribución no normal; Fig. 5A). Existió un efecto de tiempo significativo para los niveles de proteína AR (datos transformados antes del análisis debido a una distribución no normal; PRE>POST, p<0,001), pero no existió ningún efecto principal de grupo o interacción grupo×tiempo.
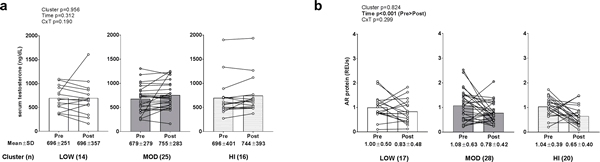
Figura 5. Alteraciones en los biomarcadores de señalización androgénica entre grupos.
Leyenda: No hubo efectos principales significativos ni interacción grupo×tiempo para la testosterona total en suero (panel a). Un efecto de tiempo significativo existió para los niveles de proteína AR (PRE>POST, p<0,001) (panel b), pero no existió ningún efecto principal de grupo o interacción grupo×tiempo. Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g005
Biomarcadores catabólicos entre grupos
No existió ningún efecto principal significativo o interacción grupo×tiempo para el cortisol en suero (Fig. 6A). Existió un efecto de tiempo significativo para los niveles de miostatina en suero (PRE>POST, p = 0,006) (Fig. 6B), pero no existió ningún efecto principal de grupo o interacción grupo×tiempo. No existieron efectos principales significativos o interacciones grupo×tiempo para los niveles de proteína NF-κB fosforilada (Fig 6C), o niveles de proteína MuRF-1 (Fig 6D). Curiosamente, una interacción grupo×tiempo se aproximó a la significancia de la actividad del proteasoma 20S (p = 0,058; Fig 6E). Dado que la interacción se aproximó a la significación estadística, se realizaron pruebas post hoc forzadas que sugirieron que la actividad del proteasoma 20S fue: a) en el punto de tiempo PRE, mayor en MOD versus LOW (p = 0,020) y mayor en HI versus LOW (p = 0,068), b) tendencia más alta en el punto de tiempo POST en comparación con PRE dentro del grupo LOW (p = 0,061; el umbral de significación es p<0,017 debido a múltiples pruebas t), y c) tendencia más baja en el punto de tiempo POST en comparación con PRE dentro del grupo MOD (p = 0,077; el umbral de significancia es p<0,017 debido a múltiples pruebas t). Existió una asociación negativa débil entre el cambio en la actividad del proteasoma 20S y el cambio en el grosor del VL (r2 = 0,057; p = 0,083). En particular, todos los datos incluidos en la Figura 6 fueron transformados antes del análisis debido a que estas variables no están distribuidas normalmente.
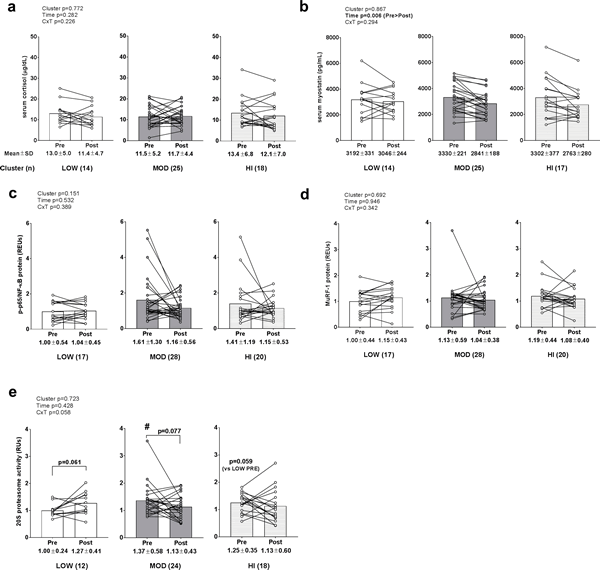
Figura 6. Alteraciones en los biomarcadores catabólicos entre grupos.
Leyenda: No existió ningún efecto principal significativo o interacción grupo×tiempo para el cortisol en suero (panel a). Existió un efecto de tiempo significativo para los niveles de miostatina en suero (PRE>POST, p = 0,006), pero no existió ningún efecto principal de grupo o interacción grupo×tiempo (panel b). No existieron efectos principales significativos o interacciones grupo×tiempo para los niveles de proteína NF-κB fosforilada (panel c), o niveles de proteína MuRF-1 (panel d). Una interacción grupo×tiempo se aproximó a la significación para la actividad del proteasoma 20S (p = 0,058) (panel e), y las pruebas post hoc forzadas revelaron que: a) los niveles PRE fueron mayores en MOD versus LOW (#; p = 0,020), b) los niveles más altos POST versus PRE en el grupo LOW se aproximaron a la significación (p = 0,061), y c) los niveles más altos PRE versus POST en el grupo MOD se aproximaron a la significación (p = 0,077). Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g006
Niveles de ARNm inflamatorio y catabólico entre grupos
No existieron efectos principales significativos o interacción grupo×tiempo para los niveles de IL-6 ARNm de músculo esquelético (Fig. 7A). Existió una interacción significativa grupo×tiempo para el ARNm de IL-1β (p = 0,029; Fig. 7B), pero no existieron efectos principales. Las pruebas post hoc revelaron que: a) los niveles PRE de ARNm IL-1β fueron mayores en MOD versus LOW (p = 0,050), y b) los niveles disminuyeron en el grupo MOD (p = 0,006; el umbral de significación es p<0,017 debido a múltiples pruebas t) y tendieron a disminuir en el grupo LOW (p = 0,019; el umbral de significación es p<0,017 debido a múltiples pruebas t) después del entrenamiento. Sin embargo, no hubo una asociación significativa entre los cambios de grosor del VL y los cambios de ARNm IL-1β entre los grupos (r2 = 0,0002, p = 0,919). Existió un efecto de tiempo significativo para el ARNm TNF-α (PRE>POST, p = 0,029; Fig 7C), pero no existió ningún efecto principal de grupo o interacción gripo×tiempo. No existió ningún efecto principal significativo o interacción grupo×tiempo para los niveles de ARNm MSTN del músculo esquelético (Fig. 7D). En particular, todos los datos de la Figura 7 fueron transformados antes del análisis debido a que estas variables no están distribuidas normalmente.
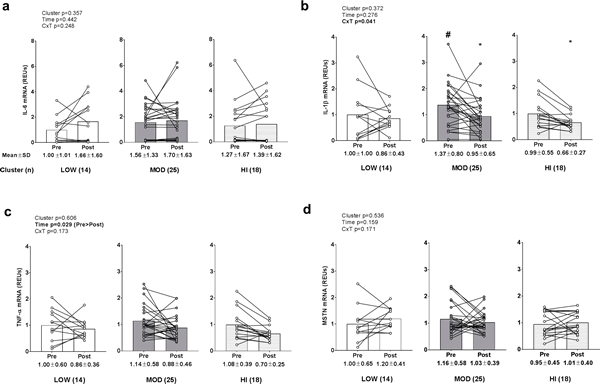
Figura 7. Alteraciones en los niveles de ARNm inflamatorio y catabólico entre grupos.
Leyenda: No existieron efectos principales significativos o interacción grupo×tiempo para los niveles de IL-6 ARNm del músculo esquelético (panel a). Existió una interacción significativa de grupo×tiempo para el ARNm IL-1β (p = 0,029 (panel b), y las pruebas post hoc revelaron que: a) los niveles PRE de ARNm IL-1β fueron mayores en MOD versus LOW (#; p = 0,050), y b) los niveles disminuyeron en el grupo MOD (*, p = 0,006) y LOW (*, p = 0,019) después del entrenamiento. Existió un efecto de tiempo significativo para el ARNm TNF-α (PRE>POST, p = 0,029) (panel c), pero no existió ningún efecto principal de grupo o interacción grupo×tiempo. No existió ningún efecto principal significativo o interacción grupo×tiempo para los niveles de ARNm MSTN del músculo esquelético (panel d). Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g007
Cambios en la fuerza de miembros inferiores entre grupos
Existió un efecto de tiempo (PRE>POST, p<0,001) y un efecto de grupo significativo (LOW>HI, p = 0,045) para la fuerza de 3RM de sentadilla (Fig. 8B), pero no hubo interacción grupo×tiempo.
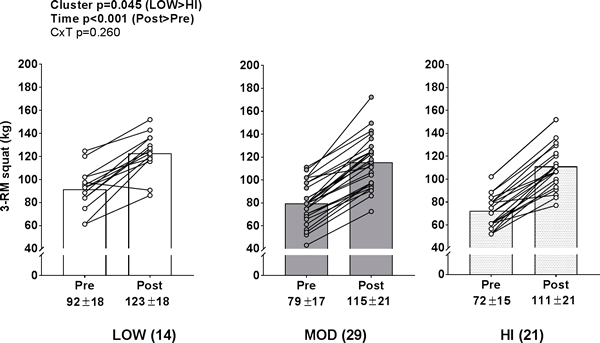
Figura 8. Cambios en la fuerza de miembros inferiores entre grupos
Leyenda: Hubo un efecto de tiempo (PRE>POST, p<0,001) y un efecto de grupo significativo (LOW>HI, p = 0,045) para la fuerza de 3-RM de sentadilla, pero no existió interacción grupo×tiempo. Los datos se presentan como valores individuales de los respondedores, los valores del gráfico de barras indican valores medios de grupo, y los valores medios ± desviación estándar se presentan debajo de cada barra.
https://doi.org/10.1371/journal.pone.0195203.g008
DISCUSIÓN
El estudio actual continúa ampliando los informes anteriores que han identificado biomarcadores que delinean las respuestas hipertróficas individuales al entrenamiento de la fuerza. Aquí, los recuentos de células satélite aumentaron en respuesta al entrenamiento, pero no se observó interacción grupo×tiempo. Nuestros hallazgos difieren de los datos publicados por el laboratorio de Bamman que informan un aumento en los recuentos de células satélite después de 16 semanas de entrenamiento de fuerza en XTR versus otros grupos [10]. Sin embargo, debe notarse que las diferencias en el diseño de los estudios (es decir, la población participante, el programa de entrenamiento, la suplementación y la duración del estudio) son potencialmente importantes para los hallazgos discrepantes. En particular, los hombres y mujeres jóvenes y mayores fueron incluidos en el estudio de Petrella et al., y una publicación anterior de este grupo que utilizó a muchos de estos mismos participantes informó que sólo los hombres más jóvenes (no los hombres o mujeres mayores) experimentaron aumentos en los recuentos de células satélite después de 16 semanas de entrenamiento de la fuerza [25]. Colectivamente, estos datos sugieren que los hombres jóvenes, sin entrenamiento, experimentan hipertrofia con aumentos concomitantes en el número de células satélite en respuesta al entrenamiento de la fuerza. Sin embargo, nuestros datos sugieren que los aumentos de células satélite en esta población no están relacionados con el grado de hipertrofia del músculo esquelético evaluado a través del grosor del VL.
Stec et al. [4] informaron que los respondedores del XTR presentaron aumentos rápidos en la hipertrofia de tipo II acompañada de aumentos en la densidad de ribosoma (es decir, el ARN total por peso del músculo evaluado) en respuesta a sólo 4 semanas de entrenamiento de la fuerza. Aunque sólo observamos un efecto significativo de tiempo para los niveles totales de ARN, realizamos un análisis post hoc forzado dado que había una puntuación de cambio de alta magnitud en el grupo HI (+32% después del entrenamiento) versus el grupo LOW (+8%). Este análisis post hoc forzado indicó lo siguiente (note que la significación no fue indicada en la Fig. 4E debido a la falta de una interacción significativa): a) los niveles de ARN total del músculo no aumentaron significativamente en el grupo LOW (p = 0,253), sino que aumentaron en el grupo MOD (p = 0,009; el umbral para la significación es p<0,017 debido a las múltiples pruebas t) y en el grupo HI (p<0,001), y b) los niveles de ARN post-entrenamiento fueron más altos en el grupo HI versus el grupo LOW (p = 0,013). Por lo tanto, postulamos que un mayor aumento en la biogénesis de ribosoma puede delinear las respuestas hipertróficas al entrenamiento de la fuerza, tal como Stec et al. y otros han informado en humanos [3,4]. Sin embargo, nuestro hallazgo de que el cambio en el ARN total del músculo sólo explica el ~8% de la varianza en los cambios de grosor del VL (r2 = 0,079) implica que este marcador puede no ser un fuerte predictor de la hipertrofia del músculo esquelético.
A pesar de que la densidad de ribosoma aumenta con el entrenamiento, los niveles de expresión de pre-ARNr 45S fueron regulados a la baja con el entrenamiento de la fuerza sin importar el grupo. De hecho, estos resultados difieren de los de Stec et al. [4] y Figueiredo et al. [3] quienes informaron que 4 y 8 semanas de entrenamiento de la fuerza, respectivamente, incrementan los niveles de pre-ARNr 45S. Sin embargo, nuestros hallazgos sugieren que la biogénesis de ribosoma probablemente opera a través de un mecanismo de retroalimentación negativa por el cual el aumento de la densidad de ribosoma inducido por el entrenamiento aquí promovió potencialmente una regulación a la baja de la transcripción de ADNr. Esta hipótesis no es infundada dado que las respuestas transcriptómicas y de la MPS al entrenamiento de la fuerza operan de manera similar, por lo que un nuevo estímulo de ejercicio provoca alteraciones fuertes en estas variables en relación con los períodos de ejercicio posteriores [26]. Sin embargo, una sola serie de 45S situada hacia el final de los 5' de la transcripción se utilizó como sustituta de la biogénesis ribosomal, lo que limita nuestra capacidad para sacar conclusiones definitivas sobre cómo el entrenamiento afectó los niveles de expresión.
Las citoquinas pro-inflamatorias (por ejemplo, TNF-α e IL-1β) aumentan la actividad proteolítica en el músculo esquelético [15,27,28]. Además, mientras que la IL-6 tiene varias funciones pleiotrópicas en el músculo esquelético [29], los datos sobre roedores [14] y humanos [30] sugieren que la IL-6 aumentada incrementa la proteólisis de la proteína muscular esquelética. La proteólisis muscular está regulada en gran medida por la inducción del atrogeno [31], y la MuRF-1 es una ligasa E3 específica del músculo que ubiquiniza las proteínas miofibrilares (por ejemplo, las cadenas pesadas de miosina, la troponina I y otras proteínas relacionadas con la miosina). Después de la poli-ubiquinación catalizada por E3, las proteínas musculares son degradadas por el proteasoma 26S que está compuesto por la partícula del núcleo enzimático 20S y la partícula reguladora 19S [32]. Observamos un efecto del entrenamiento con respecto a una regulación a la baja en los niveles de ARNm de TNF-α, y esto está de acuerdo con estudios anteriores de entrenamiento de la fuerza [33,34]. Interesantemente, los niveles de ARNm IL-1β disminuyeron significativamente en el grupo MOD y tendieron a bajar en el grupo HI, pero no fueron alterados en el grupo LOW después del entrenamiento. Además, una interacción grupo×tiempo para la actividad del proteasoma 20S se aproximó a la significación (p = 0,058), y un análisis post-hoc forzado sugirió que la actividad tendía al alza en el grupo LOW después de 12 semanas de entrenamiento de la fuerza. Aunque son especulativos, estos datos podrían indicar que la incapacidad para regular a la baja determinados ARNm pro-inflamatorios y/o una inducción en los niveles de actividad del proteasoma en los respondedores de LOW puede haber sido parcialmente responsable de la menor magnitud de la hipertrofia en este grupo en relación con otros grupos. Sin embargo, la falta de asociaciones moderadas o grandes entre los cambios en los niveles de ARNm IL-1β o en los niveles de proteasoma 20S y los cambios en el grosor del VL, sugiere que estos marcadores fueron mínimamente predictivos de la hipertrofia del VL, lo que limita la probabilidad de la hipótesis antes mencionada.
La testosterona es una hormona sexual anabólica que se une como un ligando a los receptores de andrógenos y ha sido ampliamente estudiada con respecto a su capacidad para aumentar la masa muscular esquelética mediante la estimulación de la proliferación de células satélite [35,36] y MPS [37, 38]. Mientras que otros han informado aumentos en el contenido de proteína AR muscular correlacionados con la hipertrofia muscular [16], observamos que 12 semanas de entrenamiento de la fuerza redujeron el contenido de AR independientemente del grupo. Por lo tanto, al igual que con el ARNr 45S, esta observación probablemente sugiere que los períodos de entrenamiento repetidos provocan un bucle de retroalimentación negativa con respecto a la expresión de la proteína AR. Además, no hubo ningún efecto de entrenamiento o interacción o efecto entre grupos con respecto a los niveles de testosterona en suero, lo que parece coincidir con otra bibliografía que sugiere que los cambios en la testosterona total o libre en suero con el entrenamiento de la fuerza no están relacionados con la hipertrofia del músculo esquelético [39].
La MSTN es miembro de la superfamilia de factor de crecimiento transformante-β que suprime la proliferación y diferenciación celulas satélite [40] así como la MPS en fibras musculares maduras [41]. En particular, el ARNm de la MSTN del músculo esquelético está regulado a la baja en respuesta al ejercicio agudo de la fuerza [42,43], y los niveles de proteína y ARNm de la MSTN están regulados a la baja en respuesta al entrenamiento crónico de la fuerza [44,45]. En el estudio actual, los niveles séricos de la MSTN disminuyeron con el entrenamiento independientemente del grupo, aunque los niveles de ARNm permanecieron inalterados. Aunque este último hallazgo es difícil de conciliar con bibliografía anterior, la disminución en los niveles séricos de MSTN continúa sugiriendo que el entrenamiento de la fuerza disminuye las facetas de la señalización de la miostatina.
Este hallazgo podría indicar que los que los respondedores HI no sólo tuvieron una mayor capacidad para la hipertrofia localizada del VL dado el menor grosor muscular pre-entrenamiento, sino un mayor potencial para la plasticidad muscular. De hecho, mientras que el aumento de la biogénesis de ribosoma o la reducción de la actividad del proteasoma pueden estar relacionados con este último, también hipotetizamos que los componentes de la matriz extracelular podrían estar relacionados con este fenómeno. En este sentido, otros han demostrado hipertrofias rápidas del músculo cardíaco con extirpación pericárdica [46], lo que sugiere que el tejido conectivo tiene una gran influencia en el crecimiento del tejido muscular. Asimismo, la evidencia de roedores seleccionados sugiere que los perfiles de expresión génica relacionados con la remodelación de la matriz extracelular están correlacionados con el crecimiento de las fibras musculares [47]. Por lo tanto, aunque estos marcadores no fueron evaluados aquí, especulamos que una interesante dirección de investigación futura incluiría interrogar si los respondedores LOW más jóvenes poseen características que sugieren una matriz extracelular menos maleable (por ejemplo, una mayor expresión de genes relacionados con el colágeno o componentes de tejido conectivo más gruesos a nivel de micro y macroestructura).
Finalmente, aunque hubo respuestas individuales claras con respecto a los cambios en el grosor del VL, el hecho de que todos los grupos que experimentaron aumentos similares en la masa corporal magra y la fuerza de los miembros inferiores con el entrenamiento es un hallazgo digno de mención. Como alternativa, un tema más amplio de estos datos es que los respondedores individuales LOW pueden experimentar adaptaciones positivas al entrenamiento cuando se implementa un riguroso programa diario de entrenamiento de la fuerza de periodización ondulante.
Consideraciones experimentales
En el presente estudio deben tenerse en cuenta consideraciones experimentales. En particular, la intención original de este estudio fue examinar los efectos de la L-leucina o de diferentes suplementos proteicos sobre la hipertrofia del músculo esquelético versus un placebo de carbohidratos. Sin embargo, como se informó en una investigación previa [17] y en la Tabla 1, todos los grupos con suplemento experimentaron aumentos similares en la hipertrofia de la fibra tipo II y la distribución de los participantes que consumieron varios suplementos no fue diferente entre los grupos. Aparte de esta consideración, una limitación metodológica crítica fue que no se evaluaron las respuestas agudas o crónicas de la MPS al entrenamiento. Aunque existen datos que sugieren lo contrario [48], investigaciones previas han informado eventos agudos de transducción de señales post-ejercicio asociados con aumentos de MPS (por ejemplo, aumento de la fosforilación de p706sk) o respuestas elevadas de MPS a un período inicial de entrenamiento de la fuerza que predice respuestas hipertróficas a largo plazo [49,50]. Por lo tanto, aunque en el mejor de los casos es especulativo, en el estudio actual postulamos que los respondedores HI pueden haber experimentado una mayor respuesta MPS después de cada sesión de entrenamiento en comparación con los respondedores LOW y MOD. Además, aunque nuestro estudio examinó los datos de biopsia y registro de alimentos pre- y post-intervención, es probable que las respuestas hipertróficas individuales sean el resultado de varios factores fisiológicos, ambientales y psicosomáticos que no fueron evaluados directamente y que ocurren en el día a día (por ejemplo, hábitos de sueño, niveles de estrés, etc.). Por lo tanto, se justifican investigaciones futuras que implementen diseños de estudios que aborden mejor estos temas. Una limitación no resuelta fue que nuestra POST biopsia estuvo relativamente cerca del último período de entrenamiento (72 horas), por lo que esta restricción metodológica puede haber confundido ciertos hallazgos en algunos participantes (por ejemplo, patrones de expresión de proteínas, patrones de expresión de ARNm, actividad de células satélite). Finalmente, una observación interesante para exploraciones futuras se notó aquí en que el menor espesor del VL al comienzo en el grupo HI versus el LOW no se reflejó en los respectivos valores más bajos de la fCSA tipo I y II al inicio. Como se indica en la introducción, esta observación puede estar relacionada con las diferencias inter-individuales en el número de fibras del VL. Por ejemplo, si dos sujetos tenían 500.000 fibras de VL pero el sujeto #1 tenía un grosor de VL que era un 20% mayor que el sujeto #2 al comienzo, entonces se esperaría que las fibras musculares en el sujeto #1 fueran un 20% más grandes. Sin embargo, bajo este mismo escenario de grosor del VL, si el sujeto #1 tuviera 400.000 fibras musculares y el individuo #2 tuviera un 20% más de fibras (480.000 fibras musculares) entonces se esperaría que ambos posean fibras musculares de tamaño similar. Notablemente, esta magnitud de diferencia de fibras entre los sujetos está dentro del ámbito de lo posible de acuerdo con los datos de Lexell [19], y la variación potencial inter-individual en el número de fibras ilustra por qué el análisis de imagenología hipertrófica (por ejemplo, los datos de la ecografía) puede no concordar bien con los datos histológicos de la fCSA, y estudios futuros deberían tratar de abordar este asunto.
Conclusiones
Estos datos siguen describiendo los factores que se asocian con las respuestas hipertróficas individuales al entrenamiento de la fuerza. Los individuos con menores valores de grosor del VL pre-entrenamiento y mayores incrementos en los niveles de ARN total muscular después de 12 semanas de entrenamiento de la fuerza experimentaron un mayor crecimiento muscular del VL, aunque estos biomarcadores explicaron individualmente sólo el ~8-11% de la varianza en la hipertrofia. Sostenemos que los esfuerzos de investigación que continúan identificando predictores significativos de hipertrofia permitirán determinar si tales variables pueden ser moduladas de forma individual para optimizar las adaptaciones de los ejercicios.
Agradecimientos
Los autores desean agradecer al Dr. Marcas Bamman (University of Alabama-Birmingham Medical School, Birmingham, AL, EUA) por su asesoría en la interpretación de estos datos. Los autores desean agradecer a los participantes por dedicar su tiempo a la realización de este estudio. Además, los autores desean agradecer a nuestro personal de entrenamiento, incluyendo a Jessica Nendze, Casey Sexton, Chester Davis, Romil Patel, David Baumohl y Corey Chandler por su tiempo dedicado al entrenamiento de los participantes.
Referencias
1. McGlory C, Devries MC, Phillips SM. (1985). Skeletal muscle and resistance exercise training; the role of protein synthesis in recovery and remodeling. J Appl Physiol 2017;122(3):541–8. pmid:27742803; PubMed Central PMCID: PMCPMC5401959.
2. Snijders T, Nederveen JP, McKay BR, Joanisse S, Verdijk LB, van Loon LJ, et al. (2015). Satellite cells in human skeletal muscle plasticity. Front Physiol. 2015;6:283. pmid:26557092; PubMed Central PMCID: PMCPMC4617172.
3. Figueiredo VC, Caldow MK, Massie V, Markworth JF, Cameron-Smith D, Blazevich AJ. (2015). Ribosome biogenesis adaptation in resistance training-induced human skeletal muscle hypertrophy. Am J Physiol Endocrinol Metab. 2015;309(1):E72–83. pmid:25968575.
4. Stec MJ, Kelly NA, Many GM, Windham ST, Tuggle SC, Bamman MM. (2016). Ribosome biogenesis may augment resistance training-induced myofiber hypertrophy and is required for myotube growth in vitro. Am J Physiol Endocrinol Metab. 2016;310(8):E652–E61. pmid:26860985; PubMed Central PMCID: PMCPMC4835943.
5. Wen Y, Alimov AP, McCarthy JJ. (2016). Ribosome Biogenesis is Necessary for Skeletal Muscle Hypertrophy. Exerc Sport Sci Rev. 2016;44(3):110–5. pmid:27135313; PubMed Central PMCID: PMCPMC4911282.
6. Chaillou T, Kirby TJ, McCarthy JJ. (2014). Ribosome biogenesis: emerging evidence for a central role in the regulation of skeletal muscle mass. J Cell Physiol. 2014;229(11):1584–94. pmid:24604615; PubMed Central PMCID: PMCPMC4868551.
7. Nader GA. (2014). Ribosomes 'muscle up' postnatal muscle growth. J Physiol. 2014;592(23):5143. pmid:25448183; PubMed Central PMCID: PMCPMC4262327.
8. Yang L, Song T, Chen L, Kabra N, Zheng H, Koomen J, et al. (2013). Regulation of SirT1-nucleomethylin binding by rRNA coordinates ribosome biogenesis with nutrient availability. Mol Cell Biol. 2013;33(19):3835–48. pmid:23897426; PubMed Central PMCID: PMCPMC3811878.
9. Percipalle P, Fomproix N, Cavellan E, Voit R, Reimer G, Kruger T, et al. (2006). The chromatin remodelling complex WSTF-SNF2h interacts with nuclear myosin 1 and has a role in RNA polymerase I transcription. EMBO Rep. 2006;7(5):525–30. pmid:16514417; PubMed Central PMCID: PMCPMC1479564.
10. Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM. (1985). Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell-mediated myonuclear addition: a cluster analysis. J Appl Physiol 2008;104(6):1736–42. pmid:18436694.
11. Thalacker-Mercer A, Stec M, Cui X, Cross J, Windham S, Bamman M. (2013). Cluster analysis reveals differential transcript profiles associated with resistance training-induced human skeletal muscle hypertrophy. Physiol Genomics. 2013;45(12):499–507. pmid:23632419; PubMed Central PMCID: PMCPMC3680779.
12. Jain AK. (2010). Data clustering: 50 years beyond K-means. Pattern Recognition Letters. 2010;31(8):651–66.
13. Bamman MM, Petrella JK, Kim JS, Mayhew DL, Cross JM. (1985). Cluster analysis tests the importance of myogenic gene expression during myofiber hypertrophy in humans. J Appl Physiol 2007;102(6):2232–9. pmid:17395765.
14. Haddad F, Zaldivar F, Cooper DM, Adams GR. (1985). IL-6-induced skeletal muscle atrophy. J Appl Physiol 2005;98(3):911–7. pmid:15542570.
15. Zamir O, Hasselgren PO, Higashiguchi T, Frederick JA, Fischer JE. (1992). Tumour necrosis factor (TNF) and interleukin-1 (IL-1) induce muscle proteolysis through different mechanisms. Mediators Inflamm. 1992;1(4):247–50. pmid:18475468; PubMed Central PMCID: PMCPMC2365344.
16. Mitchell CJ, Churchward-Venne TA, Bellamy L, Parise G, Baker SK, Phillips SM. (2013). Muscular and systemic correlates of resistance training-induced muscle hypertrophy. PLoS One. 2013;8(10):e78636. pmid:24130904; PubMed Central PMCID: PMCPMC3793973.
17. Mobley CB, Haun CT, Roberson PA, Mumford PW, Romero MA, Kephart WC, et al. (2017). Effects of Whey, Soy or Leucine Supplementation with 12 Weeks of Resistance Training on Strength, Body Composition, and Skeletal Muscle and Adipose Tissue Histological Attributes in College-Aged Males. Nutrients. 2017;9(9). pmid:28869573.
18. Menon MK, Houchen L, Harrison S, Singh SJ, Morgan MD, Steiner MC. (2012). Ultrasound assessment of lower limb muscle mass in response to resistance training in COPD. Respir Res. 2012;13:119. pmid:23273255; PubMed Central PMCID: PMCPMC3560243.
19. Lexell J, Henriksson-Larsen K, Winblad B, Sjostrom M. (1983). Distribution of different fiber types in human skeletal muscles: effects of aging studied in whole muscle cross sections. Muscle Nerve. 1983;6(8):588–95. pmid:6646161.
20. Rhea MR, Ball SD, Phillips WT, Burkett LN. (2002). A comparison of linear and daily undulating periodized programs with equated volume and intensity for strength. J Strength Cond Res. 2002;16(2):250–5. pmid:11991778.
21. Haff G, Triplett NT, National Strength & Conditioning Association (U.S.). (2016). Essentials of strength training and conditioning. Fourth edition. ed. Champaign, IL: Human Kinetics; 2016. xvi, 735 pages p.
22. Ahmed M, Mandic I, Lou W, Goodman L, Jacobs I, L'Abbe MR. (2017). Validation of a Tablet Application for Assessing Dietary Intakes Compared with the Measured Food Intake/Food Waste Method in Military Personnel Consuming Field Rations. Nutrients. 2017;9(3). pmid:28264428; PubMed Central PMCID: PMCPMC5372863.
23. Antonio J, Ellerbroek A, Silver T, Orris S, Scheiner M, Gonzalez A, et al. (2015). A high protein diet (3. 4 g/kg/d) combined with a heavy resistance training program improves body composition in healthy trained men and women—a follow-up investigation. J Int Soc Sports Nutr. 2015;12:39. pmid:26500462; PubMed Central PMCID: PMCPMC4617900.
24. Antonio J, Peacock CA, Ellerbroek A, Fromhoff B, Silver T. (2014). The effects of consuming a high protein diet (4. 4 g/kg/d) on body composition in resistance-trained individuals. J Int Soc Sports Nutr. 2014;11:19. pmid:24834017; PubMed Central PMCID: PMCPMC4022420.
25. Petrella JK, Kim JS, Cross JM, Kosek DJ, Bamman MM. (2006). Efficacy of myonuclear addition may explain differential myofiber growth among resistance-trained young and older men and women. Am J Physiol Endocrinol Metab. 2006;291(5):E937–46. pmid:16772322.
26. Murton AJ, Greenhaff PL. (2013). Resistance exercise and the mechanisms of muscle mass regulation in humans: acute effects on muscle protein turnover and the gaps in our understanding of chronic resistance exercise training adaptation. Int J Biochem Cell Biol. 2013;45(10):2209–14. pmid:23872221
27. Wang DT, Yin Y, Yang YJ, Lv PJ, Shi Y, Lu L, et al. (2014). Resveratrol prevents TNF-alpha-induced muscle atrophy via regulation of Akt/mTOR/FoxO1 signaling in C2C12 myotubes. Int Immunopharmacol. 2014;19(2):206–13. pmid:24534773.
28. De Larichaudy J, Zufferli A, Serra F, Isidori AM, Naro F, Dessalle K, et al. (2012). TNF-alpha- and tumor-induced skeletal muscle atrophy involves sphingolipid metabolism. Skelet Muscle. 2012;2(1):2. pmid:22257771; PubMed Central PMCID: PMCPMC3344678.
29. Munoz-Canoves P, Scheele C, Pedersen BK, Serrano AL. (2013). Interleukin-6 myokine signaling in skeletal muscle: a double-edged sword? FEBS J. 2013;280(17):4131–48. pmid:23663276; PubMed Central PMCID: PMCPMC4163639.
30. Raj DS, Moseley P, Dominic EA, Onime A, Tzamaloukas AH, Boyd A, et al. (2008). Interleukin-6 modulates hepatic and muscle protein synthesis during hemodialysis. Kidney Int. 2008;73(9):1054–61. pmid:18288103.
31. Pasiakos SM, Carbone JW. (2014). Assessment of skeletal muscle proteolysis and the regulatory response to nutrition and exercise. IUBMB Life. 2014;66(7):478–84. pmid:25052691.
32. Ben-Nissan G, Sharon M. (2014). Regulating the 20S proteasome ubiquitin-independent degradation pathway. Biomolecules. 2014;4(3):862–84. pmid:25250704; PubMed Central PMCID: PMCPMC4192676.
33. Greiwe JS, Cheng B, Rubin DC, Yarasheski KE, Semenkovich CF. (2001). Resistance exercise decreases skeletal muscle tumor necrosis factor alpha in frail elderly humans. FASEB J. 2001;15(2):475–82. pmid:11156963.
34. Lambert CP, Wright NR, Finck BN, Villareal DT. (1985). Exercise but not diet-induced weight loss decreases skeletal muscle inflammatory gene expression in frail obese elderly persons. J Appl Physiol. 2008;105(2):473–8. pmid:18535122; PubMed Central PMCID: PMCPMC2519937.
35. Sinha-Hikim I, Roth SM, Lee MI, Bhasin S. (2003). Testosterone-induced muscle hypertrophy is associated with an increase in satellite cell number in healthy, young men. Am J Physiol Endocrinol Metab. 2003;285(1):E197–205. pmid:12670837.
36. Sinha-Hikim I, Artaza J, Woodhouse L, Gonzalez-Cadavid N, Singh AB, Lee MI, et al. (2002). Testosterone-induced increase in muscle size in healthy young men is associated with muscle fiber hypertrophy. Am J Physiol Endocrinol Metab. 2002;283(1):E154–64. pmid:12067856.
37. Ferrando AA, Tipton KD, Doyle D, Phillips SM, Cortiella J, Wolfe RR. (1998). Testosterone injection stimulates net protein synthesis but not tissue amino acid transport. Am J Physiol. 1998;275(5 Pt 1):E864–71. pmid:9815007.
38. Griggs RC, Kingston W, Jozefowicz RF, Herr BE, Forbes G, Halliday D. (1985). Effect of testosterone on muscle mass and muscle protein synthesis. J Appl Physiol 1989;66(1):498–503. pmid:2917954.
39. Schoenfeld BJ. (2013). Postexercise hypertrophic adaptations: a reexamination of the hormone hypothesis and its applicability to resistance training program design. J Strength Cond Res. 2013;27(6):1720–30. pmid:23442269.
40. McFarlane C, Hennebry A, Thomas M, Plummer E, Ling N, Sharma M, et al. (2008). Myostatin signals through Pax7 to regulate satellite cell self-renewal. Exp Cell Res. 2008;314(2):317–29. pmid:17949710.
41. Taylor WE, Bhasin S, Artaza J, Byhower F, Azam M, Willard DH Jr, et al. (2001). Myostatin inhibits cell proliferation and protein synthesis in C2C12 muscle cells. Am J Physiol Endocrinol Metab. 2001;280(2):E221–8. pmid:11158924
42. Dalbo VJ, Roberts MD, Hassell S, Kerksick CM. (2013). Effects of pre-exercise feeding on serum hormone concentrations and biomarkers of myostatin and ubiquitin proteasome pathway activity. Eur J Nutr. 2013;52(2):477–87. pmid:22476926
43. Louis E, Raue U, Yang Y, Jemiolo B, Trappe S. (1985). Time course of proteolytic, cytokine, and myostatin gene expression after acute exercise in human skeletal muscle. J Appl Physiol 2007;103(5):1744–51. pmid:17823296.
44. Kim JS, Petrella JK, Cross JM, Bamman MM. (1985). Load-mediated downregulation of myostatin mRNA is not sufficient to promote myofiber hypertrophy in humans: a cluster analysis. J Appl Physiol 2007;103(5):1488–95. pmid:17673556.
45. Hulmi JJ, Kovanen V, Selanne H, Kraemer WJ, Hakkinen K, Mero AA. (2009). Acute and long-term effects of resistance exercise with or without protein ingestion on muscle hypertrophy and gene expression. Amino Acids. 2009;37(2):297–308. pmid:18661258.
46. Hammond HK, White FC, Bhargava V, Shabetai R. (1992). Heart size and maximal cardiac output are limited by the pericardium. Am J Physiol. 1992;263(6 Pt 2):H1675–81. pmid:1481894.
47. White JP, Reecy JM, Washington TA, Sato S, Le ME, Davis JM, et al. (2009). Overload-induced skeletal muscle extracellular matrix remodelling and myofibre growth in mice lacking IL-6. Acta Physiol (Oxf). 2009;197(4):321–32. pmid:19681796; PubMed Central PMCID: PMCPMC3044433.
48. Mitchell CJ, Churchward-Venne TA, Cameron-Smith D, Phillips SM. (1985). What is the relationship between the acute muscle protein synthesis response and changes in muscle mass? J Appl Physiol 2015;118(4):495–7. pmid:25257869.
49. Terzis G, Georgiadis G, Stratakos G, Vogiatzis I, Kavouras S, Manta P, et al. (2008). Resistance exercise-induced increase in muscle mass correlates with p70S6 kinase phosphorylation in human subjects. Eur J Appl Physiol. 2008;102(2):145–52. pmid:17874120.
50. Mayhew DL, Kim JS, Cross JM, Ferrando AA, Bamman MM. (1985). Translational signaling responses preceding resistance training-mediated myofiber hypertrophy in young and old humans. J Appl Physiol 2009;107(5):1655–62. pmid:19589955; PubMed Central PMCID: PMCPMC2777794.