Estrés Oxidativo en Jugadores de Fútbol Jóvenes durante la Realización de un Protocolo de Ejercicios Intermitentes de Alta Intensidad
Mariana Escobar1, Max William Soares Oliveira1, Guilherme Antônio Behr1, Alfeu Zanotto-Filho1, Luciano Ilha3, Giovani Dos Santos Cunha2, Álvaro Reischak De Oliveira2 y José Cláudio Fonseca Moreira1
1Departamento de Bioquímica – UFRGS, Porto Alegre – Brasil.
2LAPEX-UFRGS, Porto Alegre – Brasil.
3Grêmio Football Porto Alegrense - Porto Alegre, Brasil.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2009.
Publicado 15 de abril de 2010
Resumen
Palabras clave: fisiología deportiva, respuesta metabólica
INTRODUCCION
El fútbol es un deporte complejo, ampliamente practicado, en el que los jugadores necesitan poseer habilidades técnicas, tácticas y físicas para tener éxito (1). Esta modalidad se define como un ejercicio intermitente, predominantemente aeróbico, con períodos con series de alta intensidad. El hecho que los jugadores realicen 150-250 acciones de alta intensidad durante un juego y presenten valores de lactato sanguíneo de 2-14 mM indica que, durante un partido, la tasa de producción de energía anaeróbica es alta (2,3). Un análisis reciente de un partido (4) demostró que algunos esprints están separados por períodos de descanso de corta duración (<30 seg), qué afectan negativamente el rendimiento de esprint subsiguiente (5). Por esa razón, el entrenamiento con esprints largos podría mejorar el rendimiento en esprints repetidos (6). Sin embargo, sólo se han realizado algunos estudios con protocolos de esprints en humanos. En el fútbol la preparación física mediante carreras con esprints largos (>10 s) se utiliza para entrenar, ya sea la resistencia frente a la acidosis láctica o la capacidad de realizar los esprints largos a gran velocidad, ambas necesarias, por ejemplo, para un contraataque. Los esprints largos no se observan frecuentemente en los partidos de fútbol oficiales, pero desempeñan un papel esencial en la preparación física de los atletas y es una práctica habitual en los equipos brasileños.
La generación de especies reactivas de oxígeno y de nitrógeno (RNOS) se produce de manera habitual como parte del metabolismo celular normal, y aumenta en condiciones de estrés físico (7). Por lo tanto, el entrenamiento de fútbol puede producir un desequilibrio entre las RNOS y los antioxidantes, situación que se conoce como estrés oxidativo. La actividad física aumenta el consumo de oxígeno y la generación de radicales libres de diferentes maneras, de hecho entre 2% y 5% del oxígeno utilizado en la mitocondria produce radicales libres en los ejercicios aeróbicos (8). En el entrenamiento con esprints, que es un ejercicio predominantemente anaeróbico, pueden surgir otras fuentes de RNOS a través de diferentes vías: especialmente a través de la producción de xantina y NADPH oxidasa, metabolismo de prostanoides, isquemia/reperfusión, actividad fagocítica y estallido respiratorio, ruptura de las proteínas que contienen hierro, y alteración en la homeostasis del calcio (8,9). Otros procesos que involucran la producción de RNOS durante el ejercicio son el aumento en la temperatura central, en las catecolaminas y en el ácido láctico, quienes tienen la capacidad de convertir el superóxido a hidroxilo (10, 11).
El ejercicio puede asociarse con numerosos beneficios para la salud, pero la actividad física excesiva, por ejemplo el fútbol de alto rendimiento, puede producir estrés y provocar daño oxidativo en las células (12, 13). El daño celular frecuentemente se caracteriza por modificaciones en diferentes macromoléculas, entre las que se incluyen las proteínas, lípidos, y ácidos nucleicos, y puede producirse en respuesta frente a ejercicios de alta intensidad como el fútbol, que plantea grandes exigencias aeróbicas y anaeróbicas durante un partido (14-16). En el cuerpo, las RNOS se neutralizan a través de un elaborado sistema de defensa antioxidante compuesto por enzimas tales como catalasa (CAT), superóxido dismutasa (SOD), glutatión peroxidasa (GPx), y numerosos antioxidantes no enzimáticos, entre los que se incluyen las vitaminas E y C, el glutatión, la ubiquinona y los flavonoides (8,17). Se sabe que el entrenamiento físico regular constituye un factor potencial de aumento de SOD, CAT y GPX, tal como se observa en numerosos estudios, y proporciona una "protección" adicional durante los períodos de intenso estrés físico que se producirían tanto con los ejercicios aeróbicos como con los anaeróbicos (18-21). Por lo tanto, debido a la falta de información sobre los efectos redox del ejercicio físico en jugadores de fútbol, nosotros medimos la peroxidación lipídica, el nivel de carbonilación, y las actividades de las enzimas antioxidantes SOD y CAT durante un protocolo de ejercicio intermitente de alta intensidad.
METODOS
Sujetos
Dieciocho jugadores de fútbol jóvenes entrenados integrantes del equipo del Gremio de Porto Alegre (Brasil) participaron voluntariamente en este estudio.
La edad media fue 17±0,5 años y los valores medios de talla, masa corporal, y porcentaje de grasa corporal fueron: 174±5 cm, 74,0±6,5 kg y 9,7±1,6%, respectivamente. El porcentaje de grasa corporal fue estimado a través de la suma de pliegues corporales, siguiendo la metodología descripta por Jackson y Pollock (22). Todos los jugadores firmaron un consentimiento informado. El estudio fue aceptado por el Comité de Ética de Investigación de la Universidad Federal de Río Grande do Sul (UFRGS).
Ningún sujeto reportó el consumo de compuestos antioxidantes, tales como vitaminas y/o medicamentos. Se solicitó a los atletas que evitaran consumir bebidas alcohólicas o cafeína durante por lo menos 24 horas antes del día de la evaluación con ejercicios. Los atletas recibieron 500 mL de una bebida deportiva 2 horas antes del partido, para asegurar el estado de euhidratación. Los atletas no consumieron ningún fluido durante el ejercicio.
Procedimientos Experimentales
Las pruebas se realizaron en el campo de entrenamiento del estadio de Fútbol del Gremio de Porto Alegre. La temperatura y humedad relativa eran 4°C y 54%, respectivamente. Esto en Brasil se considera una temperatura fría que no causa estrés térmico adicional. Las muestras de sangre fueron recolectadas durante una sesión de entrenamiento típica, que consistió en 15 minutos de entrada en calor seguida por 10 series de esprints de 200 m repetidos dos veces (10 x 2 x 200 m) lo que significa 20 esprints de 200 metros. Hubo una recuperación de 30 s entre cada esprint de 200 metros y una recuperación de 90 s después de dos esprints consecutivos. Los atletas realizaron 200 metros en 40 segundos con una velocidad media de 18 km.h-1. Este tipo de ejercicio fue clasificado como entrenamiento de esprints repetidos de larga duración (>10 s) (23).
Las muestras de sangre (10 mL) fueron obtenidas de la vena antecubital antes e inmediatamente después del ejercicio. La separación entre plasma y fracción celular se realizó mediante centrifugación.
Deshidratación y Osmolalidad
La masa corporal se determinó con una balanza digital (Plena, modelo MS-601) antes y después del entrenamiento. Los cambios relativamente pequeños en la masa debidos a la oxidación de sustrato y a otras fuentes de pérdida de agua fueron ignorados. Se solicitó a los jugadores que ajustaran las necesidades fisiológicas (por ejemplo, micción) antes de que se efectuara la medición de la masa corporal. El porcentaje de deshidratación se calculó por la diferencia entre la medición inicial y final de la masa corporal. La osmolalidad del plasma (mOsm.kg-1) fue determinada mediante un Osmómetro a Presión de Vapor (Vapro® ,Wescor).
Concentraciones de Lactato y Glucosa en Sangre
Las concentraciones de lactato y de glucosa fueron determinadas a partir de una muestra de sangre obtenida por punción digital, que fue inmediatamente analizada con un analizador de lactato (AccuSport, Roche, Alemania) y de glucosa (Accu Check Active, Roche, Alemania).
Actividad de las Enzimas Antioxidantes
La actividad plasmática de la superóxido dismutasa (SOD, E.C. 1.15.1.1) fue determinada espectrofotométricamente a través de la tasa de inhibición de formación auto-catalítica del adrenocromo en un buffer de reacción que contenía 1 mM de adrenalina/50 de mM glicina-NaOH (pH=10,2)/1 mM catalasa, tal como se describiera previamente (Klamt et al., 2002). La actividad de la catalasa (CAT, E.C. 1.11.1.6) fue establecida determinando la tasa de disminución del peróxido de hidrógeno (H2O2) (24). Las muestras de eritrocitos (300 µL) fueron centrifugadas (3000 ×g; 10 min) y 100 µL del sobrenadante se mezclaron con 1 mL de buffer fosfato con 14 mM de H2O2 (40 µL). Luego se leyó la absorbancia a 240 nm durante 60 s.
Contenido de Grupos Carbonilo en las Proteínas
Como indicador de daño oxidativo en las proteínas se determinaron los grupos carbonilos (25). Las proteínas de 300 µl de plasma fueron precipitadas por la incubación con ácido tiobarbitúrico (TCA) 20% (100 µl) durante 5 minutos en hielo, y luego fueron centrifugadas a 4000 ×g durante 5 minutos. El precipitado (pellet) fue disuelto en 100 µl de NaOH 0,2 M, y se le agregaron 100 µl de HCl 2 M o 2,4-dinitrofenilhidrazina 10 mM (DNPH) en HCl 2 M para duplicar las alícuotas para la derivatización del blanco (tubo control) o de los grupos carbonilos, respectivamente. Las muestras fueron mantenidas durante 30 minutos a temperatura ambiente. Las proteínas fueron precipitadas con TCA, y lavadas tres veces con 500 µl 1:1 etanol:acetato de etilo con períodos de reposo de 15 minutos para remover el exceso de DNPH. Las muestras fueron disueltas en 200 µl de guanidina 6M en KH2PO4 20mM, pH 2,3.
Se leyó la absorbancia a 370 nm. El contenido de carbonilo (nmol/mg proteína) fue calculado utilizando un coeficiente de la extinción molar de 22000 M/cm a 370 nm luego de restar la absorbancia del blanco.
Daño Oxidativo en los Lípidos
La producción de malondialdehido (MDA), un indicador de peroxidación de lípidos, se evaluó a través de la cuantificación de las especies reactivas de ácido tiobarbitúrico (TBARS) tal como se describiera previamente (26). Brevemente, las muestras fueron mezcladas con 600 µL de TCA 10%, centrifugadas (10000 ×g; 10 min) y 500 µL del sobrenadante fueron mezclados con 500 µL de ácido tiobarbitúrico 0,67% (TBA). Luego, la muestra fue calentada en un baño de agua hirviendo durante 15 minutos. Las TBARS fueron determinadas por absorbancia a 532 nm.
Análisis Estadísticos
Todos los datos se expresan en forma de media±error estándar de la media. Los datos fueron analizados con el software estadístico SPSS (Versión 12.0). Para efectuar las comparaciones de las variables antes y después del ejercicio se utilizó el test-t de muestras apareadas. La significancia fue fijada en valores de p≤0,05.
RESULTADOS
Deshidratación, Osmolalidad, Glucosa y Lactato en Sangre
Los atletas se deshidrataron 1,8±0,2% de su masa corporal al final del entrenamiento. La osmolalidad del plasma en reposo fue 252,6±4,79 mOsmol.kg-1 y 272,8±4,4 mOsmol.kg-1 después del ejercicio. Los datos sugieren que el ejercicio no alterara la deshidratación. Por otra parte, se observó un aumento significativo en los niveles de glucosa y lactato en sangre después del ejercicio. Las concentraciones de glucosa en sangre en reposo y después del ejercicio fueron 82,7±2,7 mg.dL-1 y 99,2±3,4 mg.dL-1, respectivamente (Figura 1A). Las concentraciones de lactato sanguíneo en reposo y después del ejercicio fueron 1,6±0,1 mg.dL-1 y 4,1±0,4.dL-1, respectivamente (Figura 1B).
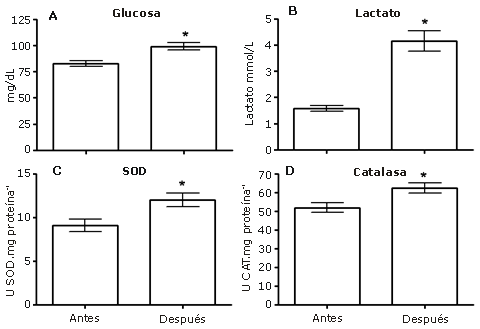
Figura 1. Panel A; Glucosa sanguínea, Panel B; Lactato sanguíneo, Panel C; Actividad de la enzima superóxido dismutasa (SOD), y Panel D; Actividad de la enzima catalasa de los eritrocitos (CAT). Los resultados se presentan en forma de media±error estándar de la media, *; p<0.05.
Parámetros de Estrés Oxidativo
La actividad plasmática de la SOD aumentó significativamente con valores en reposo de 9,10±0,71 U de SOD.mg proteína-1 y 12,0±0,8 U de SOD.mg proteína-1 después del ejercicio (Figura 1 C). La actividad de la catalasa aumentó de 51,9±2,7 U de CAT.mg proteína-1 en reposo a 62,5±2,7 U de CAT.mg proteína-1 después del ejercicio (Figura 1D).
La relación entre las enzimas (SOD/CAT) no cambió significativamente (por ejemplo, 0,18±0,01 en reposo y 0,20 ± 0,02 después del ejercicio) (Figura 2A). La peroxidación de lípidos establecida a través de la evaluación de TBARS, aumentó significativamente tomando valores de 0,32±0,02 nmol.mg proteína-1 en reposo a 0,57 ± 0,06 nmol.mg proteína-1 después del ejercicio (Figura 2B). Los grupos carbonilos en las proteínas plasmáticas aumentaron significativamente después del ejercicio, ya que su valor en reposo fue 0,59 ± 0,05 nmol.mg proteína-1 y después del ejercicio fue 1,13 ± 0,06 nmol.mg proteína-1 (Figura 2C).
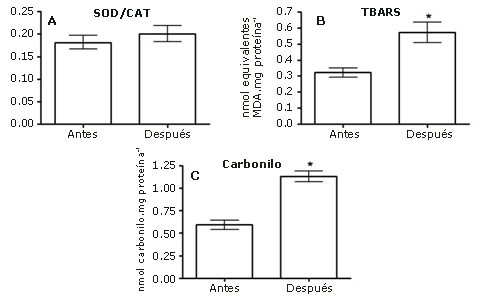
Figura 2. Parámetros correspondientes al estrés oxidativo: Panel A: Relación SOD/CAT; Panel B: Concentración plasmática de las sustancias reactivas al ácido tiobarbitúrico (TBARS); Panel C: Niveles plasmáticos de los grupos carbonilos proteicos. Los datos fueron comparados con los niveles observados en la condición reposo. Los resultados se presentan en forma de media±error estándar de la media, *; p<0.05.
DISCUSION
Deshidratación
Debido a la falta de información en este área, nosotros investigamos los efectos de ejercicio de alta intensidad sobre el estado redox [es decir, el equilibrio entre las actividades de la defensa antioxidante no enzimática y enzimática, y la producción de ROS (especies reactivas del oxígeno)].
Nosotros observamos que la pérdida de fluidos de los jugadores de fútbol era aproximadamente 1,8% de su peso corporal. Numerosos autores han demostrado que los jugadores de fútbol presentan un porcentaje de deshidratación considerable (27-29), alcanzando valores de 1,2% después de las sesiones de entrenamiento y 1,4% después de la competencia (30). El Colegio Americano de Medicina del Deportes (31) afirma que un porcentaje igual o mayor a 2% de la masa corporal señalan deshidratación, que si es acompañada por una osmolalidad plasmática superior a 290 mOsmol.kg-1 puede provocar fallas en el rendimiento. En nuestro estudio, no se observó el efecto negativo de la deshidratación. La pérdida de fluidos no produjo un menor rendimiento en los esprints repetidos. Los atletas realizaron el protocolo experimental entero sin afectar negativamente al rendimiento. Sin embargo, los parámetros de estrés oxidativo demostraron influencias claras sobre el rendimiento evaluado.
Lactato y glucosa en sangre
Si bien durante el ejercicio no se permitió el consumo de CHO, se observó un aumento significativo en la concentración de glucosa después del ejercicio. Esta observación puede ser explicada en función de factores hormonales de los jugadores, que podrían haber influenciado la cinética de la glucosa durante el ejercicio. Otros autores (32-34) también encontraron valores mayores de glucosa después del ejercicio, en comparación con los valores en reposo y también informaron aumento en los niveles de catecolaminas.
Durante el ejercicio, los niveles de glucosa en sangre son mantenidos por el hígado a través de la glucógenolisis y gluconeogenesis hepáticas. De esta manera, los niveles de glucosa en la circulación se mantienen estables. Esta relación relativamente simple y efectiva entre el hígado y el músculo esquelético se mantiene por una compleja interacción entre los reguladores neuroendócrinos circulantes y los liberados localmente (35). Las concentraciones moderadas de lactato sanguíneo encontradas en el presente estudio sugieren que la tasa de glucólisis fue elevada en todos períodos de tiempo durante el ejercicio.
Gaitanos et al. (36) no observaron cambios significativos en el lactato con su protocolo de evaluación. Los autores sugirieron que una mayor contribución del metabolismo aeróbico contrarrestaría parcialmente la reducción de la glucogenolisis anaeróbica. Por lo tanto, parecería que mientras la contribución aeróbica en un esprint simple y de corta duración, es relativamente pequeña, en los esprints repetidos habría una mayor contribución aeróbica. La contribución del sistema energético durante los esprints repetidos estaría fuertemente influenciada por la duración de los esprints (23). Luego de 20 esprints repetidos realizados en nuestro protocolo, podemos explicar los niveles moderados de lactato y los elevados niveles de glucosa en la sangre, a través de la reducción en la glucógenolisis anaeróbica y del aumento en el metabolismo aeróbico.
Actividad de las Enzimas Antioxidantes
El aumento significativo en la actividad de SOD puede ser explicado por el aumento en el radical superóxido durante el ejercicio (37). El radical superóxido está relacionado con la conversión de hemoglobina en metahemoglobina en los eritrocitos, durante el ejercicio y es convertido en H2O2 por la enzima SOD (38). En la célula, la SOD funciona como una defensa antioxidante enzimática primaria contra los radicales superóxidos, y los aumentos en la actividad de la enzima SOD, se corresponden con una mayor resistencia al estrés oxidativo (39). Otro estudio observó una relación similar, donde en jugadores del fútbol se observó una mayor actividad plasmática de la SOD en reposo que en sujetos no entrenados (40).
En nuestro estudio observamos diferencias significativas en la actividad de CAT, aunque hay pocos indicadores que sugieren que el ejercicio físico provoque aumentos en la actividad de la enzima CAT en el músculo esquelético. Algunos estudios informaron disminución o nivelación en la actividad de la catalasa de los eritrocitos después del protocolo de ejercicios (41-43).
Como enzima antioxidante, la CAT cataliza la desintegración del H2O2 para formar agua y O2. La CAT está ampliamente distribuida en la célula y hay elevadas concentraciones de la misma en peroxisomas y mitocondrias. Además, esta actividad es mayor en las fibras musculares con gran capacidad oxidativa y es más baja en aquellas fibras musculares que tienen menor capacidad oxidativa (44,45). El desequilibrio entre las enzimas antioxidantes, SOD y CAT puede provocar daño oxidativo (23, 46, 47). En nuestro estudio, la proporción SOD/CAT no cambió, lo que demostraría un equilibrio en la actividad de estas dos enzimas antioxidantes.
Daño Oxidativo en Proteínas y Lípidos
En nuestro estudio, los niveles plasmáticos de carbonilación aumentaron luego del ejercicio en comparación con los niveles observados en reposo.
Otros autores (48, 49) también observaron un aumento en los carbonilos proteicos inmediatamente después del ejercicio. Así, el ejercicio de larga duración o de alta intensidad, podría aumentar significativamente la concentración de carbonilo después del ejercicio. Diferentes factores (50) pueden desencadenar la producción de RNOS y aumentar la capacidad de oxidación de proteínas (por ejemplo, invasión de células fagocíticas, hemólisis que produce un aumento en el hierro libre y un desequilibrio en la homeostasis del calcio). El aumento en la producción de RNOS a partir de cualquiera de estas fuentes podría producir la oxidación de la cadena lateral de los aminoácidos y la fragmentación de polipéptidos, debido a que todos los aminoácidos son susceptibles a la oxidación catalizada por metales (21).
En concordancia con lo observado por otros autores (51, 52), se observó un mayor nivel de peroxidación de lípidos después del ejercicio. Sin embargo, algunos estudios (53,54) obtuvieron resultados opuestos. Esta diferencia puede deberse al hecho de que cada estudio tenía variables diferentes, como intensidad, naturaleza de la muestra y tipo de ejercicio. El aumento en MDA tendría una mayor dependencia del aumento en los niveles de consumo de oxígeno, que los períodos momentáneos de isquemia y reperfusión, infiltración de células fagocíticas o desequilibrio en la homeostasis de calcio. Estos aspectos relacionados a la lesión muscular podrían estar más relacionados con los resultados de los carbonilos proteicos (55) que con los resultados de MDA.
Concluciones
En síntesis, este estudio demostró que este tipo de protocolo específico de ejercicios con esprints repetidos produce estrés oxidativo en jugadores de fútbol. El daño oxidativo se comprueba por el aumento en los niveles de los carbonilos proteicos y de la peroxidación de lípidos. Sin embargo, el aumento significativo en la actividad de las enzimas SOD y CAT sugiere que, con este protocolo, se produce una adaptación del sistema antioxidante de estos atletas. A diferencia de los atletas aficionados, el uso de marcadores de estrés oxidativo puede ser utilizado, junto con otros marcadores, como una herramienta para prevenir lesiones y sobreentrenamiento, tanto en el fútbol profesional como en otros deportes que requieren un elevado rendimiento. Actualmente, los niños practican deportes de alto rendimiento a edades cada vez más precoces. Esos parámetros son sumamente importantes para que el entrenamiento no dañe el crecimiento y el desarrollo de los niños. De esta manera, el "estado redox " del individuo puede ser utilizado como un marcador adicional en la educación física y en la prevención de lesiones.
Dirección para Envío de Correspondencia
Mariana Escobar, MSc., Departamento de Bioquímica, ICBS - Universidade Federal do Rio Grande do Sul, Rua Ramiro Barcelos 2600 - anexo. Porto Alegre, RS, Brazil, CEP 90035-003; Tel: 55 51 33085578; correo electrónico: mariana@marianaescobar.com.br.
Referencias
1. Helgerud J., Engen L. C., Wisloff U., Hoff J (2001). Aerobic endurance training improves soccer performance. Med Sci Sports Exerc 33:1925-1931
2. Krustrup P., Bangsbo J (2001). Physiological demands of top-class soccer refereeing in relation to physical capacity: effect of intense intermittent exercise training. J Sports Sci 19: 881-891
3. Mohr M., Krustrup P., Bangsbo J (2005). Fatigue in soccer: A brief review. J Sports Sci 23:593-599
4. Spencer M., Lawrence S., Rechichi C., Bishop D., Dawson B., Goodman C. (2004). Time-motion analysis of elite field hockey, with special reference to repeated-esprint activity. J Sports Sci 22:843-850
5. Balsom P. D., Seger J. Y., Sjodin B., Ekblom B (1992). Physiological-Responses to Maximal Intensity Intermittent Exercise. Eur J Appl Physiol Occup Physiol ; 65:144-149
6. Edge J., Bishop D., Goodman C., Dawson B (2005). Effects of high- and moderate-intensity training on metabolism and repeated sprints. Med Sci Sports Exerc 37:1975-1982
7. Bloomer R. J., Goldfarb A. H., Wideman L., McKenzie M. J., Consitt L. A (2005). Effects of acute aerobic and anaerobic exercise on blood markers of oxidative stress. J Strength Cond Res 19: 276-285
8. Clarkson P. M (1995). Antioxidants and Physical Performance. Crit Rev Food Sci Nutr 35:131-141
9. Fehrenbach E., Northoff H (2001). Free radicals, exercise, apoptosis, and heat shock proteins. Exerc Immunol Rev; 7: 66-89
10. Clarkson P. M., Thompson H (2000). S. Antioxidants: what role do they play in physical activity and health? . Am J Clin Nutr 72: 637S-646S
11. Cooper C. E., Vollaard N. B., Choueiri T., Wilson M. T (2002). Exercise, free radicals and oxidative stress. Biochem Soc Trans; 30: 280-285
12. Mastaloudis A., Leonard S. W., Traber M. G (2001). Oxidative stress in athletes during extreme endurance exercise. Free Radic Biol Med; 31: 911-922
13. Sjodin B., Westing Y. H., Apple F. S (1990). Biochemical-Mechanisms for Oxygen Free-Radical Formation During Exercise. Sports Medicine; 10: 236-254
14. Bloomer R. J., Goldfarb A. H (2004). Anaerobic exercise and oxidative stress: A review. Can J Appl Physiol; 29: 245-263
15. Mastaloudis A., Leonard S. W., Traber M. G (2001). Oxidative stress in athletes during extreme endurance exercise. Free Radic Biol Med; 31:911-922
16. Krustrup P., Mohr M., Steensberg A., Bencke J., Kjaer M., Bangsbo J (2006). Muscle and blood metabolites during a soccer game: implications for sprint performance. Med Sci Sports Exerc 38:1165-1174
17. Urso M. L., Clarkson P. M (2003). Oxidative stress, exercise, and antioxidant supplementation. Toxicology 189: 41-54
18. Clarkson P. M (1995). Antioxidants and physical performance. Crit Rev Food Sci Nutr; 35: 131-141
19. Ji L. L (1995). Oxidative Stress During Exercise - Implication of Antioxidant Nutrients. Free Radic Biol Med; 18: 1079-1086
20. Leeuwenburgh C., Heinecke J. W (2001). Oxidative stress and antioxidants in exercise. Curr Med Chem; 8: 829-838
21. Radak Z., Taylor A. W., Ohno H., Goto S (2001). Adaptation to exercise-induced oxidative stress: From muscle to brain. Exerc Immunol Rev ; 7: 90-107
22. Jackson A. S., Pollock M. L (1978). Generalized Equations for Predicting Body Density of Men. Br J Nutr ; 40: 497-504
23. Spencer M., Bishop D., Dawson B., Goodman C (2005). Physiological and metabolic responses of repeated-sprint activities - Specific to field-based team sports. Sports Medicine; 35:1025-1044
24. Aebi H (1984). Catalase in vitro. In: Lester, P. eds. Methods in Enzymology Oxygen Radicals in Biological Systems. Academic Press; 121-126
25. Levine R. L., Garland D., Oliver C. N., Amici A., Climent I., Lenz A. G., Ahn B. W., Shaltiel S., Stadtman E. R (1990). Determination of Carbonyl Content in Oxidatively Modified Proteins. Methods Enzymol; 186:464-478
26. Esterbauer H., Cheeseman K. H (1990). Determination of Aldehydic Lipid-Peroxidation Products - Malonaldehyde and 4-Hydroxynonenal. Methods Enzymol ; 186:407-421
27. Barr S. I (1999). Effects of dehydration on exercise performance. Can J Appl Physiol; 24: 164-172
28. Maughan R. J., Merson S. J., Broad N. P., Shirreffs S. M (2004). Fluid and electrolyte intake and loss in elite soccer players during training. Int J Sport Nutr Exerc Metab ; 14:333-346
29. Maughan R. J., Shirreffs S. M., Merson S. J., Horswill C. A (2005). Fluid and electrolyte balance in elite male football (soccer) players training in a cool environment. J Sports Sci ; 23:73-79
30. Broad E. M., Burke L. M., Cox G. R., Heeley P., Riley M (1996). Body weight changes and voluntary fluid intakes during training and competition sessions in team sports. Int J Sport Nutr; 6:307-320
31. Sawka M. N., Burke L. M., Eichner E. R., Maughan R. J., Montain S. J., Stachenfeld N. S (2007). American College of Sports Medicine position stand. Exercise and fluid replacement. Med Sci Sports Exerc; 39: 377-390
32. Gaitanos G. C.; Williams C., Boobis L. H., Brooks S (1993). Human Muscle Metabolism During Intermittent Maximal Exercise. J Appl Physiol 75:712-719
33. Krustrup P., Mohr M., Steensberg A., Bencke J., Kjaer M., Bangsbo J (2006). Muscle and blood metabolites during a soccer game: implications for sprint performance. Med Sci Sports Exerc38:1165-1174
34. Sawka M. N., Burke L. M., Eichner E. R., Maughan R. J., Montain S. J., Stachenfeld N. S (2007). American College of Sports Medicine position stand. Exercise and fluid replacement. Med Sci Sports Exerc39:377-390
35. Coker R. H., Kjaer M (2005). Glucoregulation during exercise - The role of the neuroendocrine system. Sports Med; 35:575-583
36. Gaitanos G. C., Williams C., Boobis L., Brooks S (1993). Human Muscle Metabolism During Intermittent Maximal Exercise of Brief Duration. J Physiol London; 467: 76
37. Ji L. L., Katz A., Fu R. G., Griffiths M., Spencer M (1993). Blood Glutathione Status During Exercise - Effect of Carbohydrate Supplementation. J Appl Physiol; 74: 788-792
38. Inal M., Akyuz F., Turgut A., Getsfrid W. M (2001). Effect of aerobic and anaerobic metabolism on free radical generation swimmers. Med Sci Sports Exerc; 33: 564-567
39. Powers S. K., Lennon S. L (1999). Analysis of cellular responses to free radicals: focus on exercise and skeletal muscle. Proc Nutr Soc ; 58:1025-1033
40. Brites F. D., Evelson P. A., Christiansen M. G., Nicol M. F., Basilico M. J., Wikinski R. W., Llesuy S. F (1999). Soccer players under regular training show oxidative stress but an improved plasma antioxidant status. Clin Sci (Lond) 96:381-385
41. Aguilo A., Tauler P., Gimeno I., Fuentespina E., Pons A (2000). Changes in erythrocyte antioxidant enzymes during prolonged submaximal exercise. Biofactors ; 11:27-30.
42. Lekhi C., Gupta P. H., Singh B (2007). Influence of exercise on oxidant stress products in elite Indian cyclists. Br J Sports Med 41: 691-693
43. Tauler P., Aguilo A., Guix P., Jimenez F., Villa G., Tur J. A., Cordova A., Pons A (2005). Pre-exercise antioxidant enzyme activities determine the antioxidant enzyme erythrocyte response to exercise. J Sports Sci 23:5-13
44. Powers S. K., Lennon S. L (1999). Analysis of cellular responses to free radicals: focus on exercise and skeletal muscle. Proc Nutr Soc; 58: 1025-1033
45. Aguilo A., Tauler P., Fuentespina E., Tur J. A., Cordova A., Pons A (2005). Antioxidant response to oxidative stress induced by exhaustive exercise. Physiol Behav 84:1-7
46. Andrades M., Ritter C., Moreira J. C. F., Dal-Pizzol F (2005). Oxidative parameters differences during non-lethal and lethal sepsis development. J Surg Res 125:68-72
47. Ritter C., Andrades M., Moreira J. C. F., Dal-Pizzol F (2003). Superoxide production during sepsis development. Am J Respir Crit Care Med 167:474
48. Alessio H. M., Hagerman A. E., Fulkerson B. K., Ambrose J., Rice R. E., Wiley R. L (2000). Generation of reactive oxygen species after exhaustive aerobic and isometric exercise. Med Sci Sports Exerc 32:1576-1581
49. Bloomer R. J., Fry A. C., Falvo M. J., Moore C. A (2007). Protein carbonyls are acutely elevated following single set anaerobic exercise in resistance trained men. J Sci Med Sport; 10:411-417
50. Friden J., Lieber R. L (2001). Eccentric exercise-induced injuries to contractile and cytoskeletal muscle fibre components. Acta Physiol Scand ; 171: 321-326
51. Alessio H. M., Goldfarb A. H., Cao G. H (1997). Exercise-induced oxidative stress before and after vitamin C supplementation. Int J Sports Nutr ; 7:1-9
52. Bailey D. M., Davies B., Young I. S (2001). Intermittent hypoxic training: implications for lipid peroxidation induced by acute normoxic exercise in active men. Clin Sci (Lond) ; 101:465-475
53. Margaritis I., Tessier F., Richard M. J., Marconnet P (1997). No evidence of oxidative stress after a triathlon race in highly trained competitors. Int J Sports Med; 18:186-190
54. Gonenc S., Acikgoz O., Kayatekin B. M., Uysal N., Akhisaroglu M (2000). Effects of footshock stress on superoxide dismutase and glutathione peroxidase enzyme activities and thiobarbituric acid reactive substances levels in the rat prefrontal cortex and striatum. Neurosci Lett 289: 107-110
55. Bloomer R. J., Goldfarb A. H., Wideman L., McKenzie M. J., Consitt L. A (2005). Effects of acute aerobic and anaerobic exercise on blood markers of oxidative stress. J Strength Cond Res 19:276-285