La Carnitina: Definición y Descripción Completa
Publicado 25 de febrero de 2014, 15:59
El metabolismo lipídico involucra numerosas vías metabólicas, las que podemos resumir básicamente en dos procesos:
1-Anabolismo Graso
2-Catabolismo Graso
Los lípidos más importantes se resumen en el siguiente cuadro

Los Triacilglicéridos provenientes de la dieta, sufren en la luz intestinal degradación parcial, formando Di-acil-gliceridos, Mono-acil-gliceridos, ácidos grasos libres y glicerol, los que posteriormente son absorbidos.
Estos productos son almacenados temporalmente en el interior de las células de la mucosa intestinal y desde ahí son transportados por el sistema linfático hacia la circulación general asociándose a proteínas transportadoras ( lipo-proteínas ) y conformando unas partículas conocidas como Quilomicrones.
Los principales tejidos que son capaces de utilizar los TAG provenientes de los
quilomicrones son
1-Tejido Hepático
2-Tejido Muscular
3-Tejido Adiposo
Para que cada uno de estos tejidos pueda utilizar dichas grasas neutras, necesita que una enzima, ubicada en el endotelio de los vasos, provoque la degradación parcial de los quilomicrones, permitiendo de este modo la liberación
y posterior ingreso al interior celular de los ácidos grasos y del glicerol.
Esta enzima se denomina Lipoproteinlipasa (LPL) y es esencial en el proceso
metabólico de síntesis de grasas neutras junto al complejo enzimático Acido Graso Sintetasa.
En cada tejido, el destino final de los ácidos grasos puede variar. Por ejemplo en hígado puede ser utilizado como sustrato energético o convertido a grasas. En el músculo, prácticamente todo el ácido graso ingresado es oxidado ( “que-mado” ) con la finalidad de obtener ATP.
Finalmente en el tejido graso, su principal ruta metabólica es la del anabolismo graso.
En el siguiente cuadro vemos resumido el camino que sigue un ácido graso desde que es ingresado por vía oral hasta su captación por los distintos órganos o tejidos.
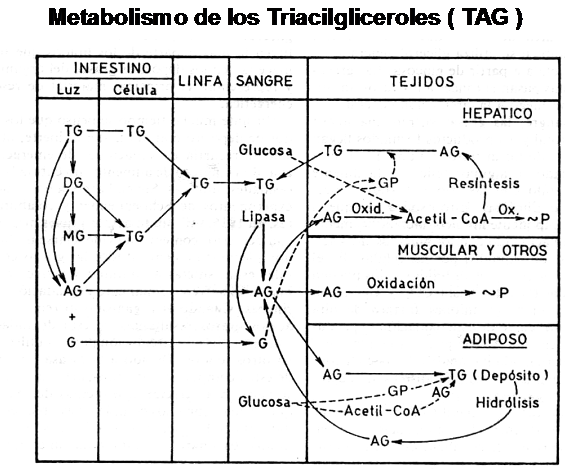
Es importante tener presente que el ingreso a la célula de los ácidos grasos es un fenómeno pasivo, dado que su estructura lipídica le permite atravesar fácil-mente la membrana plasmática.
Por otra parte, los ácidos grasos que se acumulan en el citoplasma, necesitan
atravesar una segunda membrana, en este caso la de la Mitocondria, ya que es en esta organela donde se lleva a cabo el proceso de oxidación de los mis-mos con la consiguiente obtención de energía, la que es almacenada en com-puestos fosforados, como es el caso del ATP.
Pero en esta ocasión, el acceso al interior de la matriz mitocondrial no es un proceso pasivo, sino que requiere de una activación previa del ácido graso (dando lugar a la formación de un compuesto denominado Acil-CoA) y la posterior unión con una molécula transportadora de ácidos grasos activados que se encuentra en la membrana interna de la mitocondria y que es conocida con el nombre de Carnitina
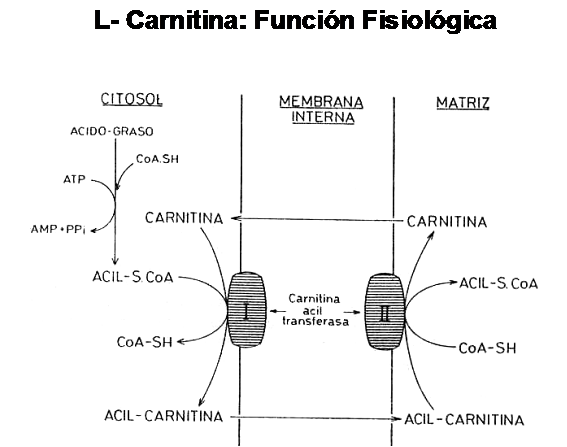
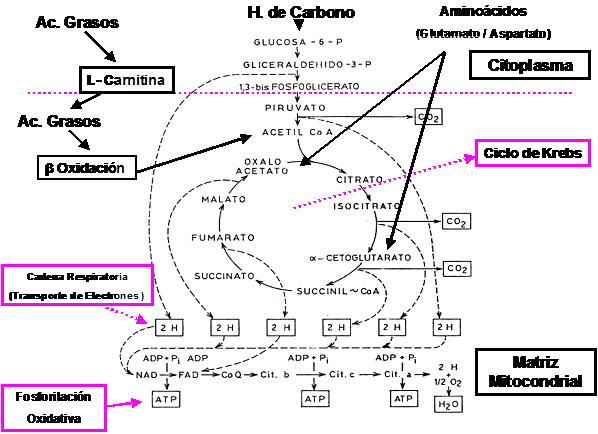
Como podemos observar en el cuadro anterior, el ácido graso activado (Acil-CoA) se une a la Carnitina formando un compuesto denominado Acil-Carnitina y libera el grupo CoA que queda libre para poder unirse a otros ácidos grasos activados. La enzima que participa en este paso es la Carnitina Acil-Transferasa I. El complejo Acil-Carnitina atraviesa entonces la membrana mitocondrial y en el interior de la misma se produce la liberación de la Carnitina y la unión del ácido graso con otra molécula de CoA, para formar nuevamente el ácido graso activado o Acil-CoA. Este paso lo cataliza la enzima Carnitina Acil-Transferasa II. La carnitina liberada difunde libremente hacia el citoplasma y está en condiciones de unirse a otro Acil-CoA y recomenzar el ciclo.
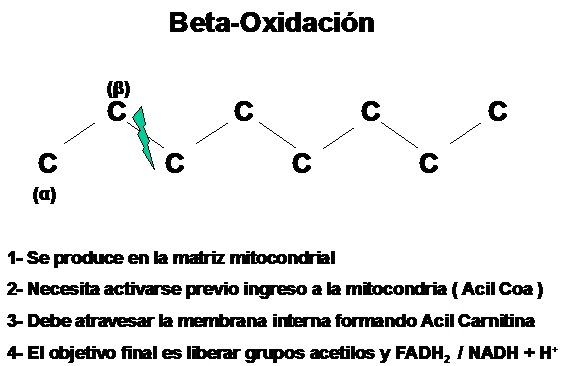
El Acil-CoA ingresado sufre un proceso de degradación parcial, con liberación secuencial de estructuras conformadas por 2 átomos de carbono en estado de activación y que se denominan Acetil-CoA.
Este proceso se degradación y liberación de grupos acetilos activados recibe el nombre de Beta-Oxidación.
Es importante tener presente que un Acil-CoA es un ácido graso de más de 2 átomos de carbono (por ejemplo ácido palmítico, que tiene 16 átomos de carbono) mientras que un Acetil-CoA es siempre una molécula de 2 átomos de carbono.
A continuación vemos un resumen de lo expuesto hasta ahora
Como se puede apreciar, también en este proceso es de destacar la formación de moléculas aceptoras de hidrógenos y electrónes ( denominados equivalen-tes de reducción ) conocidas como FAD y NAD+
Dicho de otra manera, la dehidrogenación implica la disolución de la molécula original en sus elementos constitutivos, entre ellos el H+ (protón) y el electrón del átomo de Hidrógeno
Estas párticulas son captadas por estos aceptores y transportadas en una serie de pasos ordenados, proceso denominado Cadena Respiratoria.
Durante el transporte de los equivalentes de reducción se genera energía suficiente para acoplar ADP al Pi y formar ATP.
Como se puede apreciar, para considerar que una molécula grasa es realmente “quemada”, debe sufrir dicho proceso de dehidrogenación. No alcanza con movilizarla solamente hacia otros tejidos. Tiene que haber una necesidad real de producción de ATP que genere demanda de sustratos energéticos y que provoque una elevada actividad de las vías metabólicas de producción energética, como ser el Ciclo de Krebs, la Cadena Respiratoria y la Fosforilación Oxidativa.
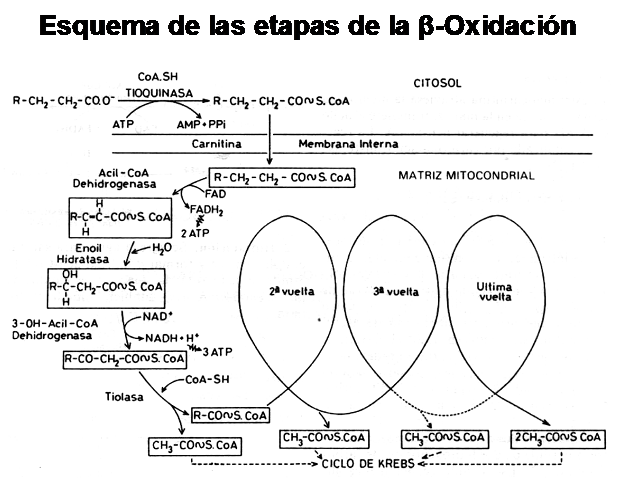
Retomando el tema de la Beta-Oxidación,
observemos el siguiente esquema:
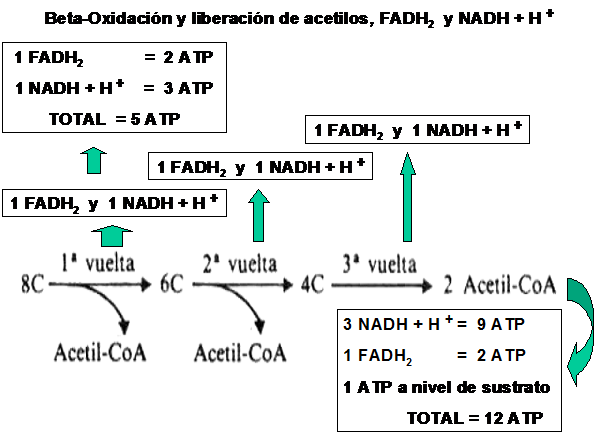
Como podemos observar, en cada ciclo de Beta-Oxidación se generan por un lado 1 Acetil-CoA y 1 FADH2 y 1 NADH + H+.
El Acetil-CoA que ingresa al Ciclo de Krebs, generará a su vez 3 NADH + H+, 1 FADH2 y 1 ATP a nivel de sustrato (es decir que genera ATP sin necesidad de intervención de la cadena respiratoria ) .Cada NADH + H+ que ingresa en la cadena respiratoria es capaz de generar 3 moléculas de ATP, mientras que ca-da FADH2 solo es capaz de genera 2 moléculas de ATP.
Por lo tanto cada Acetil-CoA que ingresa al Ciclo de Krebs y a la cadena respiratoria es capaz de formar 12 ATP.
En resúmen, por cada vuelta de Beta-Oxidación se generarán 5 ATP provenientes de cada NADH + H+ y FADH2 formado y 1 Acetil-CoA que a su vez generará 12 ATP como producto de su combustión total.
Esto representa una gran cantidad de ATP capaz de ser formado por un ácido graso, como por ejemplo, el Ác. Palmítico, que forma 129 moles de ATP, comparado con la Glucosa, que es capaz de formar entre 36 y 38 moles de ATP .
Esto justifica el concepto de tejido de reserva energética que se le adjudica a las grasas.
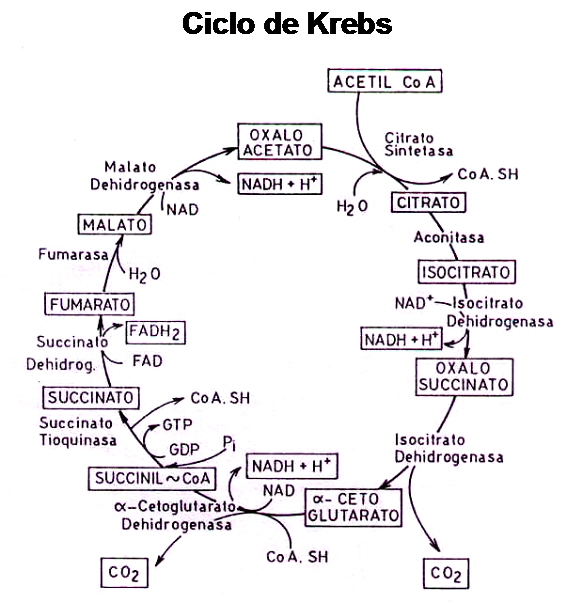
A continuación observamos un diagrama representativo de ciclo de Krebs
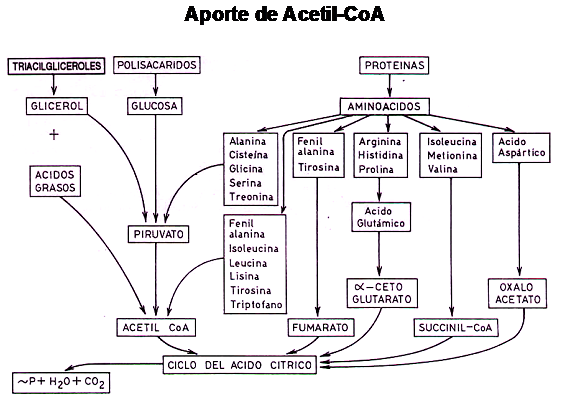
Las grasas para ser metabolizadas, deben sufrir proceso de Beta-Oxidación y generar grupos acetilos activados ( Acetil-CoA ). Pero un dato importante es que no sólo las grasas son capaces de aportar grupos acetilos activados.
Los hidratos de carbono y las proteínas aportan por distintas vías grupos acetilos activados.
Los hidratos de carbono por glucólisis generan Piruvato el que puede transformarse en Lactato o perder un átomo de carbono y formar Acetil-CoA.
Las proteínas, luego de perder su grupo Amino, por un proceso de Transaminación o Deaminación, ofrecen su esqueleto carbonado para formar grupos acetilos activados
En el esquema siguiente podemos observar la interrelación existente entre los hidratos de carbono, grasas y proteínas y su capacidad de generar Acetil-CoA.
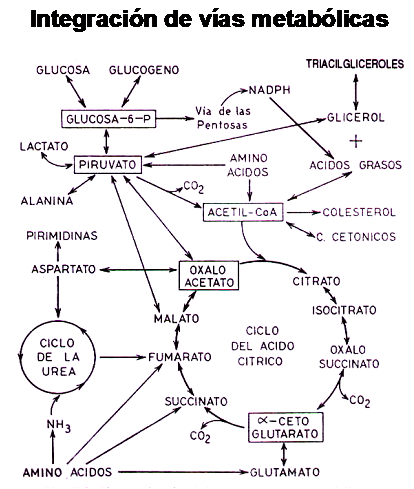
El aporte de grupos acetilos activados, tanto los generados por Beta-Oxidación como los producidos por la glucólisis o la transaminación ejerce un mecanismo de retroalimentación negativo sobre dichas vías, de manera tal que la célula es capaz de determinar sus reales demandas de Acetilos activos y frenar el continuo aporte de los mismos por las mencionadas vías.
Pero en ciertas situaciones, como por ejemplo en una Diabétes descompensada, la producción de grupos acetilos activados no puede ser detenida y los mis-mos comienzan a acumularse, lo que activa,una vía metabólica que conduce a la formación de los denominados Cuerpos Cetónicos.
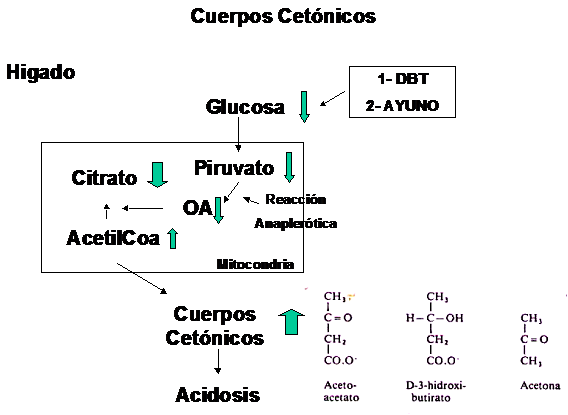
Para la comprensión de este proceso, es necesario entender lo siguiente:
1-Al no poder ser utilizada la glucosa como sustrato energético, la demanda
de otros sustratos, entre ellos la de ácidos grasos aumenta
Aumenta la actividad de la LHS, la Carnitina y la Beta-Oxidación
2-El organismo no logra interpretar que el problema no es la ausencia de glu-
cosa, sino su imposibilidad de ingresar al interior celular
3-Por tal motivo, intensifica la síntesis de novo de glucosa (Gluconeogénesis)
y utiliza integrantes del ciclo de Krebs, entre otros el Oxalo-Acetato, como
sustrato para la síntesis de glucosa
4-Además uno de los principales mecanismos por los cuales el organismo ob-tiene oxalo-acetato, es por medio de una reacción en donde interviene el Piruvato, reacción denominada Anaplerótica.
Nuevamente debido a la imposibilidad de ingresar glucosa a la célula, no es
posible realizar esta reacción que suministra oxalo-acetato
5-El oxalo-acetato es fundamental para que el Acetil-CoA pueda ingresar al
ciclo de Krebs, uniéndose al mismo y formando Citrato
6-La disminución de Oxalo-Acetato provoca disminución de la tasa de ingreso
de Acetil-CoA y este comienza a acumularse, derivando en la síntesis de
cuerpos cetónicos
7- Esto conduce a una acidificación sanguínea situación conocida como Ceto-
Acidósis.
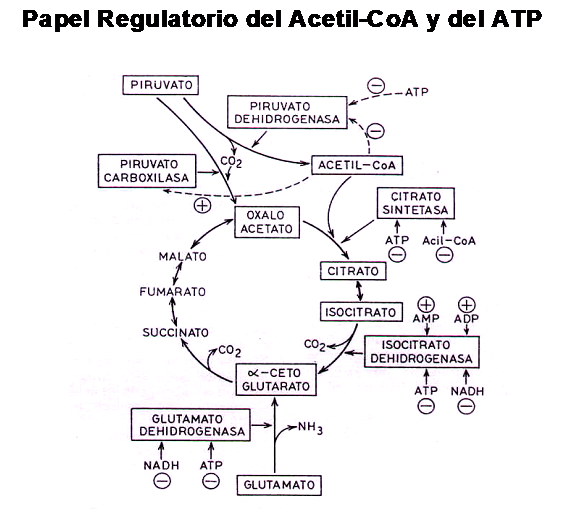
Habíamos mencionado que la formación de grupos acetilos activados es capaz
de regular la concentración intracelular de acetil-CoA, y esto lo lleva a cabo por medio de dos mecanismos:
1-Inhibiendo a la Piruvato Dehidrogenasa, enzima que cataliza la conver-
sión de Piruvato en Acetil-CoA
2-Estimulando a la Piruvato Carboxilasa, enzima que cataliza la síntesis
de Oxalo-Acetato
A su vez los ácidos grasos activos ( acil-CoA ) también inhiben a una enzima
denominada Citrato Sintetasa, debido a que intenta regular el funcionamiento
del ciclo de Krebs frenando el drenaje de Oxalo-acetato hasta que sus niveles
de concentración estén en condiciones de satisfacer la oferta de Acetil-CoA
existente
Por otra parte, todo esto puede verse reforzado por una sobre-oferta de ATP, el cual inhibe enzimas importantes del ciclo de Krebs
Dicho de otra forma, si la demanda energética no se ve aumentada, el exceso de ATP formado y no utilizado deprime el ciclo de krebs y detiene tanto la oxidación de glucosa como la de ácidos grasos, a pesar del aumento de la oferta de los mismos, por aumento de la actividad de la Lipasa Hor-mono Sensible ( LHS ) y por el aumento de la actividad de la L-Carnitina.
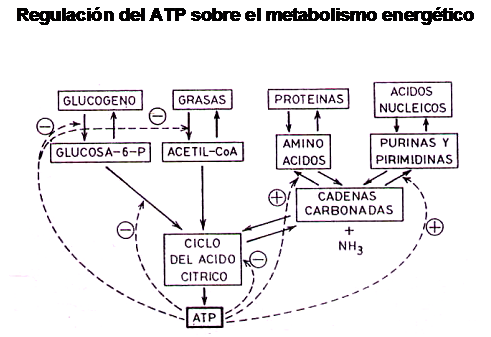
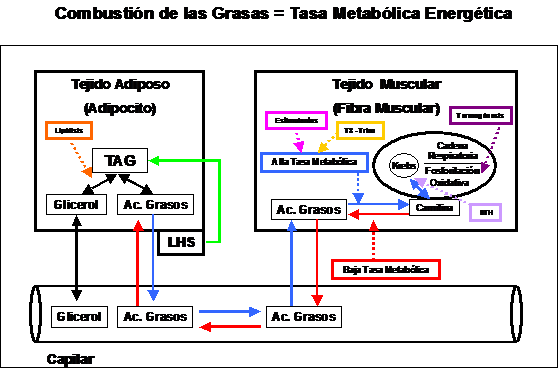
Quiere decir que la cantidad de energía demandada por unidad de tiempo ten-drá repercusión directa sobre la posibilidad de metabolizar entre otras cosas a los ácidos grasos. se conoce como Tasa Metabólica Energética
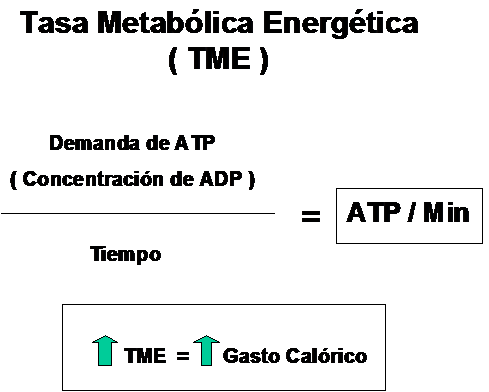
Dicho de otro modo, cuanto más elevada sea la TME, mayor aumento del Gasto calórico tanto en reposo como en actividad.
Este aumento de demanda de energía beneficiará la acción de diversas sustancias entre ellas la Carnitina.
Por lo tanto, repetimos, la movilización de TAG desde el tejido adiposo es solo una parte del largo recorrido que tienen que hacer los ácidos grasos hasta llegar a ser oxidados, es decir “quemados” dentro de la mitocondria.
Los mecanismos de regulación que dependen de los niveles de ATP, ADP, AMP y Acetil-CoA, entre otros, marcarán el ritmo de consumo de sustratos, como por ejemplo las grasas, a través de la regulación de la actividad de diversas enzimas y procesos metabólicos, como por ejemplo la activación o inhibición de las Carnitinas Acil Transferasas I y II, de las tioquinasas que estimulan la formación de acidos grasos activados ( Acil-CoA ), y la estimulación o inhibición de la Beta-Oxidación.
Por lo tanto, podemos concluir que la alta disponibilidad de un componente del sistema de movilización de las grasas, como puede ser por ejemplo la Carnitina no asegura la oxidación de las grasas.
Si no hay demanda energética, las grasas son capaces revertir el proceso de transporte de grasa, conduciendo nuevamente las grasas hacia el tejido de depósito y estimulando la Lipogénesis
La síntesis de ácidos grasos “de Novo” (
Lipogénesis ) utiliza un complejo enzi-mático conocido Acido Graso Sintetasa
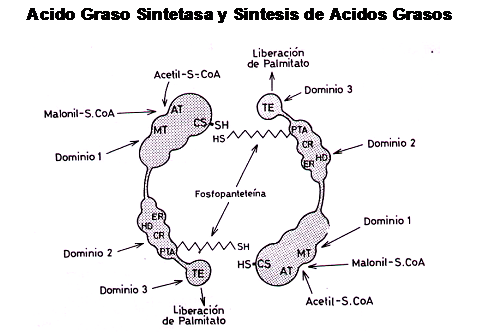
Para que este complejo enzimático actúe, es necesario que el aporte de Acetilos activados sea continuo y elevado
Pero los acetilos provenientes de la Beta-Oxidación están en la matriz mitocondrial y la membrana interna de la mitocondria no es permeable a estos compuestos. Por otra parte, el sistema de transporte de la L-Carnitina funciona in-troduciendo ácidos grasos de cadena media / larga de manera preferencial en vez de extraerlos, además de tener poca afinidad con estructuras de 2 átomos de Carbono
Por este motivo, se necesita un sistema que permita la salida de grupos acetilos, y este mecanismo se describe a continuación
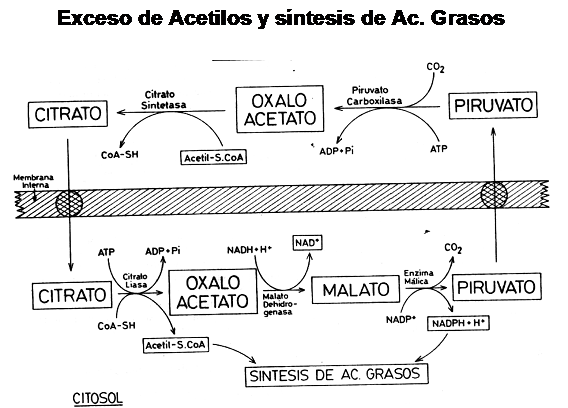
Este sistema utiliza la conversión de oxalo-acetato en Citrato, el cual puede a-travesar la membrana mitocondrial utilizando un transportador de ácidos tri-carboxílicos e intercambiándose con Malato. Una vez en el citoplasma, el citrato libera un grupo acetilo y forma nuevamente oxaloacetato. De esta forma, los acetilos activados están en condiciones de ser utilizados para iniciar la síntesis de ácidos grasos de cadena media / larga
Hasta ahora hemos descripto con cierta profundidad algunos aspectos relacionados con el metabolismo graso.
Pero concretamente, la carnitina es efectivamente un “quemador de grasas”?
Para responder este interrogante, comenzaremos describiendo dicha sustancia
La carnitina, cuyo nombre químico es Acido Beta-Hidroxi-Gamma- Trimetil – Amonio-Butírico es un compuesto que surge de la combinación de ciertos aminoácidos.
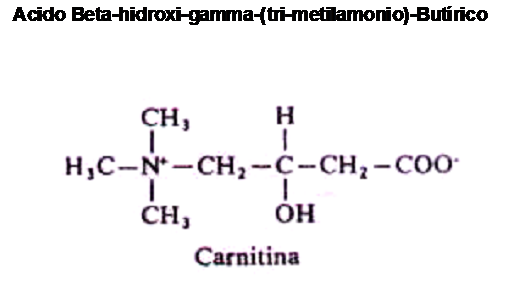
En la literatura científica, suele asignársele
diversas funciones que se listan a continuación:

Como se puede observar, dentro de las funciones mencionadas, no figura ninguna que tenga que ver con el aumento del metabolismo basal o con el aumento de la tasa metabólica energética. Es decir, no hay un aumento de la demanda de ATP.
Esto lleva a una acumulación de ATP y de Acetilos Activos, que al no ser utilizados porque las necesidades energéticas de la célula en cuestión están cubiertas, provoca inhibición del ciclo de Krebs, inhibición de la Beta-Oxidación y reversión del proceso de lipólisis con retorno de las grasas no oxidadas al tejido adiposo y estimulación de la síntesis de acidos grasos de Novo en el cito-plasma de la célula sobrecargada de acetilos.
Sin embargo, a pesar de lo
expuesto anteriormente, hay algunos trabajos cien-tíficos que concluyen que es
posible obtener beneficios en el rendimiento de-portivo con el uso de
L-Carnitina, los que se enumeran a continuación

Analizando los items asociados con la mejora del rendimiento deportivo, podemos decir que el incremento de la Potencia aeróbica máxima es factible, ya que al mejorar el transporte y la utilización de grasas como sustrato energético, se promueve un ahorro importante en la utilización de glucosa / glucógeno como sustrato energético principal, lo que indirectamente deriva en una probabilidad
de disminuir la producción de lactato y de esta manera retardar la aparición de fatiga como consecuencia del retardo en la aparición de acidosis metabólica.
Por otra parte, este aumento en la disponibilidad de ácidos grasos como sustrato energético, provocaría un efecto anticatabólico sobre la masa muscular, debido a que las demandas sobre dicho tejido para aportar aminoácidos se verían disminuidas.
Otros trabajos mencionan los beneficios que se pueden esperar obtener con el consumo de L-Carnitina en aquellos individuos que están intentando perder pe-so corporal.

Lógicamente que la disminución de lípidos sanguíneos y su supuesto efecto a-norexígeno favorecerían y facilitarían los procesos asociados con la disminución de grasa corporal.
Pero no queda muy claro si realmente evita la ceto-ácidosis o la estimula. Por lo visto anteriormente, en dietas hipocalóricas, donde el consumo de grasas e hidratos de carbono puede estar muy disminuído, esto puede conducir a una hipoglucemia muy marcada, que desencadenará en un aumento de la gluco-neogénesis a partir del oxalo-acetato, primer componente del ciclo de Krebs.
Este drenaje de intermediaros del ciclo de Krebs interferiría con el ingreso de acetilos activos, los que no pueden unirse al oxalo-acetato para formar citrato y continuar con las diversas reacciones enzimáticas que componen este ciclo.
De esta manera, los Acetil-CoA al no poder ser oxidados, utilizan al oxalo-acetato para salir de la mitocondria e iniciar la síntesis de los denominados cuerpos cetónicos, los que al aumentar en forma desmedida, conducirán a una situación metabólica conocida como Ceto-Acidósis. Particularmente soy más partidario de pensar que el exceso de L-Carnitina puede provocar cetoacidosis si se dan las condiciones expuestas, es decir hipoglucemia y aumento del aporte de Acetil-CoA proveniente no solo de la Beta-Oxidación sino aquellos acetilos activos provenientes del catabolismo protéico.
Con respecto a las formas de presentación de esta sustancia en el mercado de suplementos deportivos, podemos ver en el siguiente cuadro, las características mas sobresalientes:

En cuanto a la forma de consumo, podemos afirmar que es conveniente suministrar este suplemento minutos antes de cualquier actividad deportiva, principalmente aquellas que superen los 90 minutos de duración.
La dosis recomendada es entre 15 y 30 mg / kg / día y se aconseja no combinar su ingesta con otros aminoácidos, ya que existe posibilidad de que dichos aminoácidos puedan interferir y disminuir su absorción a nivel intestinal
Dentro de los efectos secundarios indeseables, encontramos que dosis superiores a los 5 grs / día pueden provocar diarrea.
Más alla de este efecto adverso, la ingesta de L-Carnitina se considera muy segura, además de NO SER CONSIDERADA una sustancia dopante

Para finalizar diremos que está ampliamente reconocida su función de transportador de grupos acilos activados ( Acil-CoA )
Es necesario tener presente que si las demandas de ATP no están aumentadas, la producción de ATP proveniente de la Beta-Oxidación provocará un aumento de la concentración de ATP intracelular, lo que lleva a dicho elemento a inhibir determinadas enzimas reguladoras de las distintas vías metabólicas, entre ellas la Beta-Oxidación y el Ciclo de Krebs .
De esto se desprende que es necesario aumentar el gasto metabólico diario incrementando la actividad física, lo que metabólicamente significa provocar un descenso de los niveles de ATP intracelular, lo que provocaría un aumento en
la utilización de grasas como sustrato energético, estimulando diversas enzimas, entre ellas la Lipasa Hormono Sensible, que permite la remoción de TAG del tejido adiposo, la Tioquinasa, que estimula la síntesis de Acilos Activos ( Acil-CoA ), y otras enzimas integrantes del proceso de Beta-Oxidacíon, ciclo de Krebs, transporte de electrones y Fosforilación oxidativa, además de estimular una mayor actividad de la L-Carnitina como transportador de grupos acilos activados desde el citoplasma al interior de la matriz mitocondrial
En pocas palabras, el aumento en el transporte de grupos acilos activados al interior de la mitocondria no se correlaciona con una mayor tasa de oxi-dación de acidos grasos.
Es necesario intepretar el proceso como un conjunto de vías metabólicas relacionadas, cuyo principal regulador es la demanda de energía para la realización de trabajo biológico, y en donde el ingreso de acilos activos
a la matriz mitocondrial es solo un aspecto parcial de todo el proceso.
Referencia Bibliográfica
·Borum, R. (1985) Role of Carnitine during Development . Canadian Journal of Physiolgical Pharmacology, vol. 63, pp. 571-576
·Borum, R. York, C.M., and Broquist, H.P. (1979) Carnitine Content of Liquid Formulas and Special Diets. American Journal of Clinical Nutrition, vol. 32, pp. 2272-2276
·Bremer, J. (1983). Carnitine-Metabolism and Functions. Physiological Reviews, vol. 63, pp. 1420-1480
·Broquist, P. and Borum P.R. (1982). Carnitine Biosynthesis, Nutritional Implications. Advances in Nutritional Research, vol 4. pp. 181-204
·de Jong, J.W. & Ferrari, R (1997). The Carnitine System. A New Therapeutical Approach to Cardiovascular Diseases. Deventer, The Netherlands: Kluwer Academic Publishers.
·de Simone, C & Famularo, G. (Editor) (1997) Carnitine today. Texas: Lands Bioscienes.
·Fraenkel, G. and Friedman, S. (1957). Carnitine. Vitamins and Hormones, vol. 15, pp. 73-118. New York: Academic Press
·Fritz, I.B. (1963). Carnitine and Its Role en Fatty Acid Metabolism. Advances in Lipid Research, vol 1, pp. 285-334
·Genger, H.,Enzelsberger, H., and Salzer, H. (1988). L-Carnitine als Therapie der Plazentainsuffizienz-Erste Erfahrungen. Geburtsh. U. Perinat. 192, pp. 155-157
·Genger, H., Sevelda P., Vytiska-binstorfer, H., Salzer, H., Legenstein, E., and Lohninger, A. (1988) L-Carnitin-Spiegel wahrend der Schwangerschaft. Geburtsh. U. Perinat. 192, pp. 134-36
·Gulewitsch, W. and Krimberg, R.(195). Zur Kenntins der Extraktivstoffe der Muske. Über das L-Carnitin. Hoppe-Seylers Zeischrift fuer Physiologische Chemie, vol. 45 pp. 326-330
·Hughes, R.E (1988) Ascorbic Acid, Carnitine and Fatigue. Medical Science Research, vol. 15. pp. 721-723
·Hughes, R.E (1982) The Vitamin C, Carnitine, Fatigue Relationship. Vitamin C. Conference Proccedings. Editor: Counsell, J.N and Hornig, D.H., pp. 75-86. London: Applied Science
·Khan, L and Bamji, M.S. (1979. Tissue Carnitine Deficiency. Journal of Nutrition, vol 109, pp. 24-31
·Lombard, K. A., Olson, A.L., Nelson, S.E., and Retouche, C.J., (1989) Carnitine Status of Lactoovovegetarians and Strict Vegetarian Adults and Children. American Journal of Clinical Nutrition, vol 50. pp. 301-306
·Mitchel, M.E.(1978) Carnitine Metabolism in Human Subjects. I. Normal Metabolism. The American Journal of Clinical Nutrition, vol 31, pp. 293-306
·Scholte, H.R. and de Jonge, P.C. (1987). Metabolism , Function and Transport of Carnitine in Health and Disease. Carnitine in der Medizin, pp. 21-59. Edited by R. Gitzelmann. Stuttgart: Schattauer Verlag
·Tao, R.C., and Yoshimura, N.N. (1980). Carnitine Metabolism and Its Application in Parenteral Nutrition. Journal of Parenteral and Enteral Nutrition, vol. 4, pp. 469-486
·Crayhon R. (1998). The Carnitine Miracle. New York: M. Evans &Co
·Leibowitz, B.E. (1998) L-Carnitine – The Energy Nutrient. Good Healtch Guides. Keats:USA
·Hughes, R.E., (University of Wales) (1993) L-Carnitine-Some Nutritional and Historical Implications. Edition Lonza
·R. Ferrari, S. Dimaur, G. Scherwood (1992) L-Carnitine-Some Nutritional and Historical Implications. Edition Lonza
·R. Ferrari, S. Dimaur, G. Scherwood (1992) L-Carnitine and Its Role in Medicine: From Function to Therapy. London: Academic Press.
·E. Kaiser & A. Lohninger (1987). Carnitine – Its Role in Lung And Heart Disorders. Basel Switzerland: Karger Verlag
·“ Respiratory Chain Enzymes in Muscle of Endurance Athletes: Effect of L-Carnitine “ Huerts, R., et al. Biochemical and Biophysical Research Communications, 188: 102-106:192
·“Defective Myocardial Carnitine Metabolism in Consgestive Heart Failure Secondary to Dilated Cardomyopathy and to Coronary Hypertensive and Valvular Heart Diseases”, Reitz, Vera . M.D. , et. al. The American Journal of Cardiology . March 15, 1990: 755-760
·“Nutritional Ergogenic Aids: Carnitine”. Clarkson. Priscilla, M., International Journal of Sports Nutrition, 1992. 2: 185-190
·“The Effect of L-Carnitine on the AZT-Induced Destruction Of Human Myotubes”. Semino Mora, Maria Cristina, M.D., et. al. Laboratory Investigation, 1994: 71(5): 773-781
·“Effects of L-AcetylCarnitine on Functional Recovery of Hemiplegic Patients”. Patti, F., et al.Clinical Trials Journal. 1988: 25 (Supp.1), 87-101
·“Clinical and Neurochemical Effects of Acetyl-LCarnitine in Alzheimers Disease”. Pettergrew, J.W. et al. Neurobiology of Aging, 1995: 16(1):1-4 “Acetyl Levo-carnitine Protects Against MPTP –induced Parkinsonism in Primates”. Body-Wollner, l., et al. Jouranl of Neural Transmission, 1991:3: 663-72
·“Acetyl-L-Carnnitine as a Modulator of the Neuro Endocrine-Immune Interaction in HIv+ Subjects”. De Simone , C., and Calvani, M., in Stress and Immunity and Aging: A Role for Acetyl- L- Carnitine, Elseiver, New York. 1989, 125-138
·“Acylcarnitine Deficiency in Chronic Fatigue Syndrome”, Kuratsune, H., et al. Clinical Infectious Diseases, 1994: 18 (Supp1): S 62-7
