Los Reflejos de Estiramiento Pueden Influir en la Mejora de la Fuerza Durante la Ejecución del SSC
Stretch Reflexes can have an Important Role in Force Enhancement During SSC Exercise
Paavo V. Komi 1 y Albert Gollhofer 2
1Departamento de Biología de Actividad Física, Univ. de Jyvaskyla, Finlandia.
2Departamento de Ciencias del Deporte, Universidad de Stuttgart (Alemania).
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 26, Número 3 del año 2012.
Publicado 20 de septiembre de 2012
Resumen
Palabras clave: reflejos de estiramiento, ciclo de estiramiento-acortamiento, energía elástica, potencia, fuerza
Abstract
Keywords: stretch reflexes, stretch-shortening cycle, elastic energy, power, strength
INTRODUCCION
El ciclo de estiramiento-acortamiento (SSC) del músculo tiene un propósito bien reconocido: la mejora de la realización de la fase final (acción concéntrica) en comparación con la acción concéntrica aislada (ej., Komi, 1984). Esto puede demostrarse en la preparación del músculo aislado con estimulación eléctrica constante (ej., Cavagna, Dusman & Margaría, 1968), en la locomoción animal con activación natural y variable del músculo (ej., Gregor y otros, 1988) y en las condiciones de máximo esfuerzo de las acciones del SSC humano (Cavagna y otros, 1968; Komi, 1983). Ingen Schenau y otros parecen coincidir con este concepto básico. Sin embargo, para tratar los mecanismos implicados en la potenciación del rendimiento los autores usan el salto con contramovimiento (CMJ) como su modelo básico del SSC. A nuestro entender, un SSC eficaz exige tres condiciones fundamentales: una preactivación oportuna del (de los) músculo(s) antes de la fase excéntrica, una breve y rápida fase excéntrica y la inmediata transición (corta demora) entre el estiramiento (fase excéntrica) y el acortamiento (fase concéntrica). Aun cuando puede demostrarse fácilmente que el CMJ genera una mayor altura del salto en comparación con el salto en cuclillas (SJ) (Asmussen & Bonde-Petersen, 1974; Cavagna, Komarek, Citterio & Margaria, 1971; Komi & Bosco, 1978), no cumple bien todos los criterios para un SSC eficiente.
El propósito de este comentario no es intentar explicar todos los aspectos de la mejora del rendimiento discutidos en el artículo objetivo. En cambio, hemos escogido centrarnos en el argumento de que los reflejos de estiramiento pueden ser muy importantes en la regulación de la rigidez del músculo, que consiguientemente mejoraría la fuerza y potencia durante los SSCs. Por consiguiente, no coincidimos con el artículo objetivo en que los reflejos de estiramiento han limitado las posibilidades para actuar en los SSCs. No discutiremos el reflejo H —mencionado en el artículo objetivo— porque el reflejo H no es un fenómeno que se produzca de forma natural y tiene poco en común con los verdaderos reflejos de estiramiento. Para muchos aspectos neurofisiológicos y mecánicos, es evidente que el CMJ no es un modelo adecuado para extenderse sobre la especificidad de los SSCs. En cambio, se intentan encontrar actividades más “normales” como correr y saltar a la pata coja, en las que las condiciones de preactivación, estiramiento más rápido y breve periodo de transición se cumplen correctamente. Además, las fuerzas medidas en el complejo músculo-tendón durante estas actividades pueden presentar una clásica forma tipo “rebote de pelota” (Figura 1).
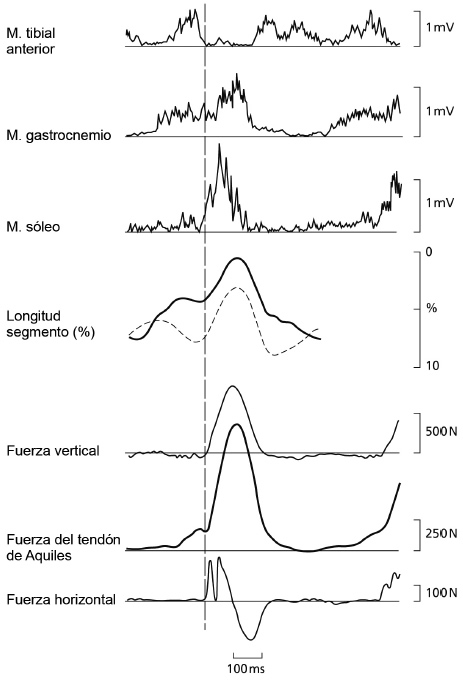
Figura 1. Un registro representativo de la fuerza del tendón de Aquiles y de los cambios de longitud de los músculos gastrocnemio y sóleo. Junto con las fuerzas de reacción del suelo Fz y Fy y las actividades del EMG seleccionadas cuando el sujeto corría por una larga plataforma de fuerza. La línea vertical Indica el comienzo del contacto con el suelo así como del ciclo estiramiento-acortamiento (SSC) de los músculos. Las desviaciones ascendentes y descendentes de los cambios de la longitud segmental significan, respectivamente, las fases de estiramiento (excéntrica) y de acortamiento (concéntrica) del ciclo. En “Stretch- Shortening Cycle” de P.V. Komi, 1992, en P.V. Komi (Ed.), Strength and Power in Sport (p. 171) Oxford, UK: Blackwell Scientific.
POSIBILIDADES DE LOS REFLEJOS DE ESTIRAMIENTO PARA ACTUAR DURANTE EL SSC
No hay duda que los reflejos de estiramiento juegan un importante papel en la regulación de la rigidez. Hoffer y Andreassen (1981) demostraron adecuadamente que cuando los reflejos están intactos, la rigidez del músculo es mayor por la misma fuerza funcional que en un músculo arreflexivo. Por consiguiente, los reflejos de estiramiento pueden tener una contribución neta a la rigidez del músculo ya durante la parte excéntrica del SSC. Esta podría ser una lógica consecuencia de cómo los husos musculares y los órganos del tendón de Golgi (GTO) influyen en el control de la longitud y tensión del músculo (Houk & Rymer, 1981). Es difícil imaginar que 105 reflejos propioceptivos, cuya existencia se conoce perfectamente hace siglos, no jugaran un papel significativo en la locomoción humana que incluye los SSCs. Sin embargo, es cierto que en los movimientos normales con gran actividad EMG, la magnitud y contribución neta de la regulación refleja de la fuerza muscular son metodológicamente difíciles de valorar. La tarea se vuelve mucho más fácil cuando uno estudia flexiones dorsales pasivas relativamente lentas (1.2-1.9 rad/s), en las que el EMG reflejo inducido de estiramiento mejora la fuerza del tendón de Aquiles (ATF) un 200-500% por encima del puro estiramiento pasivo sin potencial EMG reflejo (Gollhofer, Komi, Voigt & Nicol, 1995; Nicol & Komi, 1997; Nicol, Komi, Belli, Huttunen & Partio, 1995; ver también la Figura 2a).
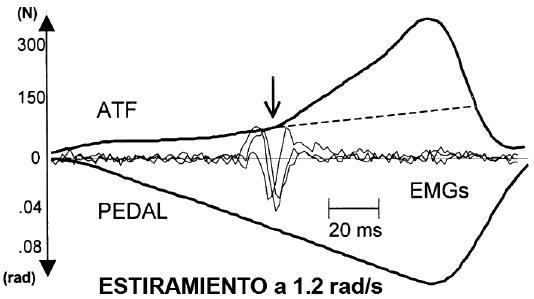
Figura 2a. Demostración de los reflejos de estiramiento en las condiciones pasivas y activas del músculo tríceps sural. Estiramiento de la flexión dorsal pasiva a 1.2 rad/s. El estiramiento más lento (ej., 0.4 rad/s) no provocó la respuesta del EMG y por consiguiente sin respuesta del ATF adicional más allá de la pura influencia pasiva. La línea de rayas representa la curva cuando no se produjera respuesta del EMG. La contribución del reflejo a la mejora de la fuerza es el registro ATF sobre esta línea. En Significance of Passively Induced Stretch Reflexes on Achilles Tendon Force Enhancement de C. Nicol & P.V. Komi, 1997.
En estas condiciones, la demora temporal entre el EMG y la mejora de la fuerza varia entre 13 y 15 ms.
En la carrera y el salto a la pata coja normales, incluso cuando se realizan submáximamente, la contribución del reflejo al EMG total puede deberse sustancialmente a un gran número de unidades motrices que reciben los estímulos aferentes la con la condición de velocidades de estiramiento relativamente altas (10-12 rad/s en la articulación del tobillo). A este respecto, el salto a la pata coja y la carrera se diferencian mucho del CMJ o del SJ. Mientras que el desplazamiento angular de la articulación del tobillo es evidente y rápido durante el salto a la pata coja, el CMJ y el SJ incluso pueden no mostrar en absoluto la fase de estiramiento (ver la Figura 3 en Fukashiro, Komi, Jarvinen & Miyashita, 1993). La situación no cambiaría considerablemente si uno considera las posibles consecuencias del comportamiento del músculo de dos articulaciones.
En el salto a la pata coja y en la carrera, el componente del reflejo de estiramiento de breve latencia (SLC) puede observarse muy fácilmente, especialmente en el músculo sóleo. La Figura 2 ilustra los registros obtenidos en las condiciones en las que este componente se presenta claramente en las pautas del EMG cuando se promediaban varios ensayos. Las Figuras 2b (Gollhofer, Strojnik, Rapp & Schweizer, 1992) y 2c (Voigt, Dyhre-Poulsen & Simonsen, 1997) son comparables saltos a la pata coja con ambas piernas con breves tiempos de contacto. Voigt y otros (1997) median en estas condiciones tanto el alargamiento del músculo desde el origen hasta la inserción como el alargamiento de la fibra muscular. Ambas mediciones mostraron altas velocidades de estiramiento en la fase inicial de contacto, lo que llevó a los autores a concluir que las condiciones eran suficientes para la activación aferente del huso muscular. El SLC es sensible a las condiciones de carga, como se ilustra en la Figura 3 [pág. siguiente], en la que las cargas de estiramiento varían desde el salto a la pata coja submáximo preferido (los registros en la parte superior) hasta los saltos en caída. En la condición más alta del salto en caída (80 cm) el componente SLC se vuelve menos claro, lo que sugiere la menor facilitación de los husos musculares y/o el mayor impulso inhibidor desde varias fuentes (ej., GTO, mecanismos de protección voluntaria, etc.). En los casos en los que los saltos en caída se han realizado desde alturas excesivas (ej., desde 140 cm, Kyröläinen y Komi, 1995), los sujetos han soportado fuerzas extremas durante el contacto. En estas situaciones, la activación reducida del reflejo puede servir funcionalmente como estrategia de protección para evitar la lesión del músculo y/o del tendón.
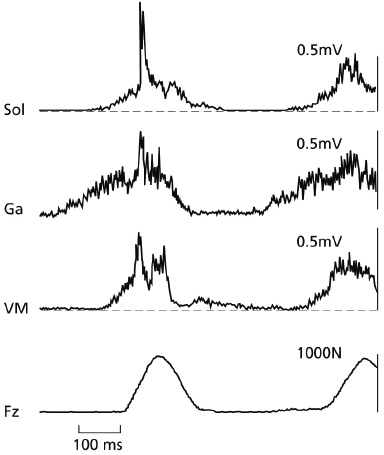
Figura 2b. Registros del EMG promediados rectificados de los músculos sóleo, gastrocnemio y vasto medial en el salto en caída desde 60 cm de altura. Advertir el afilado reflejo máximo del EMG en el músculo sóleo durante las primeras fases del contacto en las Figuras 2a y 2b.
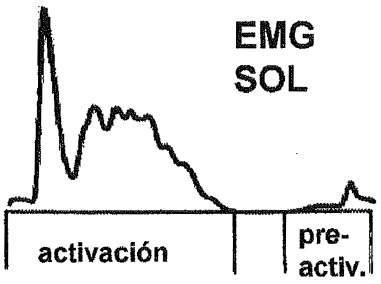
Figura 2c. Respuesta EMG rectificada y suavizada del músculo sóleo en el breve contacto del salto a la pata coja. De Modulation of Short Latency Reflexes During Human Hopping de M. Voigt, P. Dyhre-Poulsen & E.B. Simonsen, 1997, manuscrito presentado para su publicación.
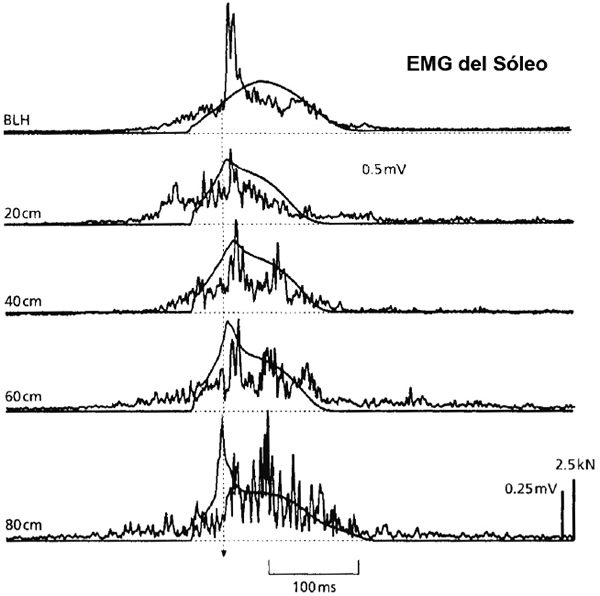
Figura 3. Pauta de EMG rectificada y promediada del músculo sóleo y fuerza de reacción vertical del suelo en varios saltos en caída del ciclo estiramiento-acortamiento con ambas piernas. La figura ilustra la modulación en la pauta y en el registro de la fuerza con una creciente carga de estiramiento. De arriba abajo: BLH (brincos sin desplazarse con ambas piernas), 20 cm -80 cm (saltos en caída desde 20-80 cm de altura, aterrizando con ambas piernas). La línea vertical discontinua indica la iniciación de la activación fásica con una latencia de 40 ms después del contacto con el suelo.
Las variaciones en la entrada aferente la durante el SSC se han valorado también en experimentos sobre la fatiga. La moderada fatiga del SSC podría provocar la leve potenciación del componente SLC (Gollhofer, Komi, Fujitsuka & Miyashita, 1987) pero una exhaustiva ejecución del SSC puede reducir drásticamente la amplitud del reflejo de estiramiento mecánicamente inducido (Nicol, Komi, Horita, Kyröläinen & Takala, 1996). La Figura 4 es un ejemplo de registros de EMG de una prueba de salto de trineo, en los que el EMG del sóleo mostraba un claro componente SLC antes de un maratón. En las mediciones tomadas inmediatamente después del maratón, el componente respectivo desapareció casi completamente. La reducción de la entrada del reflejo al grupo de motoneuronas alfa naturalmente tendrá considerables consecuencias en la ejecución del SSC (ver, por ej., Nicol y otros, 1996), aunque los detallados mecanismos de la fatiga están más allá del propósito de este comentario.
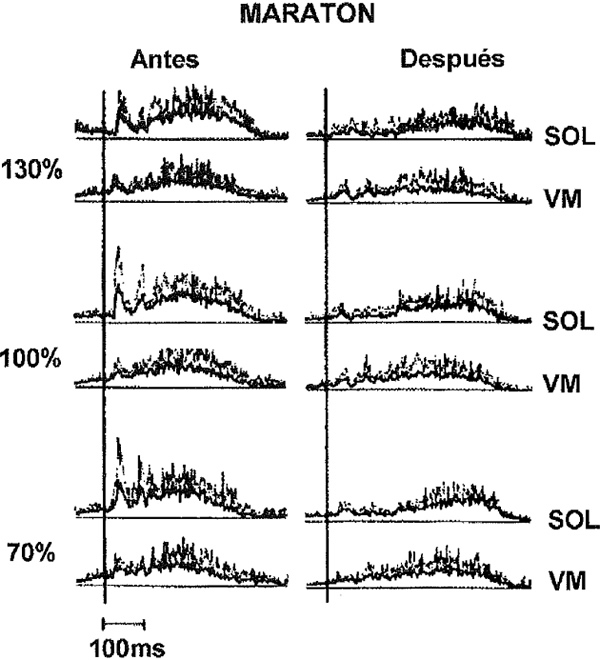
Figura 4. Demostración de la reducción en la actividad del reflejo de estiramiento después de un maratón agotador, Las pautas del EMG se promedian sobre 10 saltos con rebote sucesivos en un trineo desde diferentes alturas. En la condición “después del maratón”, 35 ms después del contacto del pie, una clara segmentación máxima es constante. Esta segmentación inicial no podría observarse en la condición similar después del maratón. De Interaction Between Muscle Stiffness and Stretch Reflex Sensitivity After Marathon Running de J. Avela & P. V. Komi, 1997, manuscrito presentado para su publicación.
SIGNIFICADO FUNCIONAL DE LOS REFLEJOS DE ESTIRAMIENTO EN LAS ACTIVIDADES DEL SSC
La eficacia del rendimiento motriz está determinada básicamente por una potente producción de fuerza. En un SSC, esto sólo puede llevarse a cabo mediante una inmediata transición desde el complejo músculo-tendón preactivado y excéntricamente estirado hasta el impulso concéntrico. Sin embargo, la amplitud de la gran rigidez está limitada a la de la “rigidez elástica de escasa amplitud” (SRES) (Morgan, 1977; Rack & Westbury, 1974). Aquí, la rigidez del complejo músculo-tendón depende no sólo de la extensión del movimiento (Kearney & Hunter, 1982) sino también de la eficacia del sistema del reflejo de estiramiento (Houk & Rymer, 1981; Nichols & Houk, 1976). Pueden esperarse grandes actividades del reflejo de estiramiento después de un poderoso estiramiento de un sistema muscular activado (Dietz, Quintern & Berger, 1984; Gollhofer & Schmidtbleicher, 1989; Greenwood & Hopkins, 1976, 1977; Melvill Jones & Watt, 1971; Vallbo, 1981). Se ha demostrado que estos reflejos de estiramiento son necesarios, no sobre todo para agrandar la amplitud de la gran rigidez (SRES) sino para linealizar las características de tensión-esfuerzo (Hufschmidt & SChwaller, 1987; Nichols, 1974).
En un SSC, puede asumirse que el alargamiento inicial del complejo músculo-tendón en el músculo tríceps de la pantorrilla se produce en el flexible tendón de Aquiles. En cuanto se alcanza una tensión “crítica”, determinada por la cantidad de actividad transmitida a los músculos antes del contacto, el intenso abandono de los enlaces cruzados de los complejos de actomiosina está acompañado por una pérdida de la energía potencial almacenada en los puentes cruzados alargados (Flitney & Hirst, 1978; Ford, Huxley & Simmons, 1978; Joyce, Rack & Westbury, 1969; Rack & Westbury, 1974). De estudios in vitro se sabe que el abandono de los enlaces cruzados activos puede evitarse mediante la intensa activación muscular.
La gran fase de la activación muscular dependiente y desencadenada puede ser proporcionada eficazmente desde un sistema receptor que es muy sensible a los cambios de longitud y tensión en el sistema músculo-tendón. Por diversas razones, el sistema del reflejo de estiramiento parece ser el candidato más adecuado para generar esta intensa activación muscular fásica: Primera, las latencias de los picos del EMG en los músculos estirados están 40- 45 ms después del contacto con el suelo (ver también la Figura 5). Según el tamaño del músculo y del sujeto, estas latencias se emparejan perfectamente con las respuestas de estiramiento después de la estimulación mecánica (Gollhofer & Rapp, 1993; Nicol & Komi, 1997). Segunda, los instantáneos diagramas fuerza-longitud (Komi, 1992) y EMG-longitud (Gollhofer y otros, 1992) muestran que 45 ms después del contacto, el músculo tríceps de la pantorrilla está en el estado isométrico, que normalmente dura 80 ms o menos. Las latencias así como la duración coinciden bien con la existencia del SLC y del MLC (Dietz, 1987; Lee & Tatton, 1982; Marsden, Merton & Morton, 1976). Tercera, según Stein (1982) y Nichols (1987), es el sistema del reflejo de estiramiento el que proporciona una gran linealidad en la rigidez muscular. Y cuarta, los aspectos antes mencionados pueden ser responsables en parte de las observaciones de que la eficiencia mecánica en la ejecución natural del SSC es superior a la del puro ejercicio concéntrico (ej., Aura & Korrd, 1986; Kyröläinen y otros, 1990). Especialmente el concepto de almacenamiento elástico favorece la existencia de la activación del reflejo. Por consiguiente, es evidente que la gran activación muscular durante la fase excéntrica del SSC es un prerrequisito para el almacenamiento eficiente de energía elástica. Funcionalmente, el músculo proporciona tensión en el complejo músculo-tendón y el tendón atenúa los cambios de longitud.
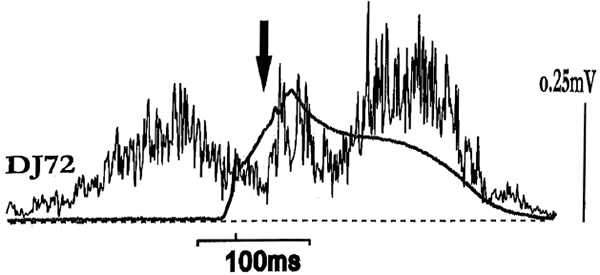
Figura 5. Pauta de EMG rectificada y promediada del m. gastrocnemio y fuerza de reacción vertical del suelo de un salto en caída desde una altura de 72 cm. El perfil del EMG muestra una clara reducción en la amplitud antes del contacto, que es constante hasta la fase media del contacto. La fase de reducción es dispersada por una contribución fásica del EMG (ver la flecha vertical) que se produce 43 ms después del contacto con el suelo.
En los saltos en caída con grandes cargas de estiramiento, la inhibición neuromuscular a menudo se observa antes que la activación del reflejo (Figura 4). Prochazka, Schofield, Westerman y Ziccone (1977) observaron un comportamiento similar en el reflejo de los gatos. Los autores trataron estas reducciones como una estrategia del sistema neuromuscular para restaurar las motoneuronas para generar una activación desencadenada y sincronizada de todas las unidades, a la vez que el contacto con el suelo (es decir, que el estiramiento de los músculos extensores).
Un músculo electrónicamente estimulado responde a los estiramientos de la rampa con incrementos de la tensión lineal sólo si el músculo tiene un sistema reflejo intacto (Nichols, 1987; Nichols & Houk, 1976). Esta linealidad se limita a pequeños cambios de longitud (ej., Hoffer & Andreassen, 1981; Joyce y otros, 1969; Noth, 1985). Entonces surge la cuestión de si estos pequeños cambios de longitud son relevantes para las realizaciones del salto en caída. Varios cambios de longitud están indicados en la literatura, lo que demuestra que la amplitud efectiva de SRES en las preparaciones in vitro es de 1-4% (ej., Fard y otros, 1978; Huxley & Simmons, 1971). En el complejo músculo-tendón intacto in vivo, este valor se incrementa porque la elasticidad en serie y la geometría de la fibra deben tenerse en cuenta. Esto causaría el alargamiento músculo-tendón hasta 6~8%. Como demostraron Komi (1992) y Gollhofer y otros (1992), los cambios de longitud del tríceps de la pantorrilla en la carrera y en los saltos en caída son del 6-9% durante el contacto. Cuando se realizan las mediciones a nivel de la fibra muscular, los valores son naturalmente menores, como demostraron Roberts, Marsch, Weyand y Taylor (1997) en la carrera del pavo en un suelo horizontal.
Por consiguiente, parece haber suficiente apoyo para el argumento de que el reflejo de estiramiento contribuye significativamente a la generación de la fuerza durante el aterrizaje en actividades con SSC como el salto a la pata coja y la carrera. Según los tipos de salto a la pata coja, por ejemplo, la amplitud del máximo reflejo del SLC puede variar considerablemente. Además, la combinación de la activación secundaria del “prerreflejo” y la posterior activación del reflejo podrían representar una situación que apoya la compensación producida y el rápido ritmo de desarrollo de la fuerza (Voigt y otros, 1997).
Referencias
1. Asmussen, E., y Bonde-Petersen, F (1974). Apparent efficiency and storage of elastic energy in human muscles during exercise. Acta Physiologica Scandinavica, 92, 537-545.
2. Aura, O., y Komi, p.v. (1986). The mechanical efficiency of locomotion in men and women with special emphasis on stretch-shortening cycle exercises. European Journal of Applied Physiology, 55, 37-43.
3. Avela, J., y Komi, P.V. (1997). Interaction between muscle stiffness and stretch reflex sensitivity after marathon running. Manuscript submitted for publication.
4. Cavagna, G.A., Dusman, B., y Margaria, R. (1968). Positive work done by a previously stretched muscle. Journal of Applied Physiology, 24, 21-32.
5. Cavagna, G.A., Komarek, L., Citterio, G., y Margaria, R. (1971). Power output of the previously stretched muscle. In J. Vredenbregt y J. Wartenweiler (Eds.), Medicine and sport, Vol6: Biomechanics II (pp. 159-167). Basel, Switzerland: Karger.
6. Dietz, V. (1987). Role of peripheral afferents and spinal reflexes in nonnal and impaired human locomotion. Revue Neurologique, 4, 241-254.
7. Dietz, V., Quintern, J., y Berger,W. (1984). Corrective reactions to stumbling in man. Functional significance of spinal and transcortical reflexes. Neuroscience Letters, 44, 131-135.
8. Dietz, v., Schrrridtbleicher, D., y Noth, J. (1979). Neuronal mechanisms of human locomotion. Journal of Neurophysiology, 42,1212-1222.
9. Fellows, S., Domges, F., Topper, R., Thilmann, A., y Noth. J. (1993). Changes in the short and long latency stretch reflex components of the triceps surae muscle during ischaemia in man. Journal of Physiology, 472, 737-748.
10. Flitney, FW., y Hirst, D.G. (1978). Cross-bridge detachment and sarcomere “give” during stretch of active frog´s muscle. Journal of Physiology, 276, 449-465.
11. Ford, L.E., Huxley, A.F., y Simmons, R.M. (1978). Tension responses to sudden length change in stimulated frog muscle fibres near slack length. Journal of Physiology, 269, 441-515.
12. Fukashiro, S., Komi, P.v., Järvinen, M., y Miyashita, M. (1993). Comparison between the directly measured Achilles tendon force and the tendon force calculated from the joint ankle movement during vertical jumps. Journal of Clinical Biomechanics, 8, 25-30.
13. Gollhofer, A., Komi, P.v., Fujitsuka, N., y Miyashita, M. (1987). Fatigue during stretch-shortening cycle exercises: n. Changes in neuromuscular activation patterns of human skeletal muscle. International Journal of Sports Medicine, 8, 38-41.
14. Gollhofer, A, Komi, P.V., Voigt, M., y Nicol, C. (1995). Mechanical contribution of isolated stretch evoked EMG responses. In K Hakkinen, KL. Keskinen, P.v. Komi, y A Mero (Eds.). Book of abstracts from the XVth International Congress of Biomechanics, University offyviiskylii, Finland (pp. 330-331).
15. Gollhofer, A, y Rapp, W. (1993). Recovery of stretch reflex responses following mechanical stimulation. European journal of Applied Physiology, 66, 415-420.
16. Gollhofer, A, y Schmidtbleicher, D. (1989). Stretch reflex responses of the human m. triceps surae following mechanical stimulation. Journal of Biomechanics, 22,1016.
17. Gollhofer, A, Strojnik, v., Rapp, w., y Schweizer, L. (1992). Behavior of triceps surae muscletendon complex in different jump conditions. European journal of Applied Physiology, 64, 283-291.
18. Greenwood, R., y Hopkins, A (1992). Landing from an unexpected fall and a voluntary step. Brain Research, 99, 375-386.
19. Greenwood, R., y Hopkins, A (1977). Muscle responses during sudden falls in man. journal of Physiology, 254, 507-518.
20. Gregor, RJ., Ray, R.R., Whiting, W.C., Lovely, KG., Hodgson, I.A., y Edgerton, V.K (1988). Mechanical output of the cat soleus during treadmill locomotion: In vivo vs. in situ characteristics. journal (of Biomechanics, 21(9), 721-732.
21. Hoffer, J.A, y Andreassen, S. (1981). Regulation of soleus muscle stiffness in premamillary cats. Intrinsic and reflex components. Journal of Neurophysiology, 45, 267-285.
22. Houk, J.c., y Rymer, W.Z. (1981). Neural control of muscle length and tension. In V.B. Brooks (Ed). Handbook of physiology. The nervous system (pp. 257-323). Baltimore: Waverly Press.
23. Hufschmidt, A, y Schwaller, I. (1987). Short-range elasticity and resting tension of relaxed human lower leg muscles. Journal of Physiology, 393, 451-465.
24. Huxley, A.F., y Simmons, R.M. (1971). Proposed mechanism offorce generation in striated muscle. Nature, 233, 533-538.
25. Ingen Schenau, G.J. van, Bobbert, M.F., y Haan, A de. (1997). Does elastic energy enhance work and efficiency in the stretch-shortening cycle? . Journal of Applied Biomechanics, 13, 389-415.
26. Joyce, G.C., Rack, P.M.H., y Westbury, D.K (1969). The mechanical properties ofcat soleus muscle during controlled lengthening and shortening movements. Journal of Physiology, 204, 461- 474.
27. Kearney, KE., y Hunter, tW. (1982). Dynamics of human ankle stiffness. Vmiation with displacement amplitude. Journal ofBiomechanics, 15,753-756.
28. Komi, P.V. (1983). Elastic potentiation of muscles and its influence on sport performance. In W. Baumann (Ed.). Biomechanik und sportliche Leistung (pp. 59-708). Schorndorf, Germany: Verlag Karl Hofmann.
29. Komi, P.V. (1984). Physiological and biomechanical correlates of muscle function: Effects of muscle structure and stretch-shortening cycle on force and speed. Exercise and Sport Sciences Reviews, 12, 81-121.
30. Komi, P.v. (1992). Stretch-shortening cycle. In P.V. Komi (Ed.). Strength and power in sport (pp. 169-179). Oxford, UK: Blackwell Scientific.
31. Komi, P.V., y Bosco, C. (1978). 1978). Utilization of stored elastic energy in leg extensor muscles by men and women. Medicine and Science in Sports, 10(4), 261-265.
32. Kyröläinen, H., y Komi, P.v. (1995). Differences in mechanical efficiency in athletes during jumping. European journal of Applied Physiology, 70, 36-44.
33. Kyröläinen, H., Komi, P.v., Oksanen, P., Hakkinen, K, Cheng, S., y Kim, D.H. (1990). Mechanical efficiency of locomotion in females during different kinds of muscle actions. European Journal of Applied Physiology, 61, 446-452.
34. Lee, KG., y Tatton, W.G. (1982). Long latency reflexes to imposed displacements of the human wrist. Dependence on duration of movement. Experimental Brain Research, 45, 207-216.
35. Marsden, C.D., Merton, P.A, y Morton, H.B. (1976). Stretch reflex and servo action in a variety of human muscles. Journal of Physiology, 259, 531-560.
36. Melvill Jones, G., y Watt, G.D. (1971). Muscular control of landing from unexpected falls in man. Journal of Physiology, 219, 729-737.
37. Morgan, D.L. (1977). Separation of active and passive components of short-range stiffness of muscle. American Journal of Physical Medicine, 232, 45-49.
38. Nicol, C., y Komi, P.V. (1997). Significance of passively induced stretch reflexes on Achilles tendon force enhancement. Manuscript submitted for publication.
39. Nicol, c., Komi, P.V., Belli, A, Huttunen, V., y Parlio, E. (1995). Reflex contribution of Achilles tendon forces: in-vivo measurements with the optic fibre technique. In K. Hakkinen, K.L. Keskinen, P. V. Komi, y A Mero (Eds.). Book of abstracts from the XVth International Congress of Biomechanics, University of Jyväliskylä, Finland (pp. 674-675).
40. Nicol, C., Komi, P.V., Horita, T, Kyröläinen, H., y Takala, TE.S. (1996). Reduced stretch-reflex sensitivity after exhausting stretch-shortening cycle (SSC) exercise. European Journal of Applied Physiology, 72, 401-409.
41. Nichols, TR. (1974). Soleus muscle stiffness and its reflex control. Unpublished doctoral dissertation, Harvard University, Cambridge, MA
42. Nichols, TR. (1987). The regulation of muscle stiffness. Medicine and Science in Sports and Exercise, 26, 36-47.
43. Nichols, TR., y Houk, I.C. (1976). Improvement in linearity and regulation of stiffness that results from actions of stretch ref1ex. Journal of Neurophysiology, 39, 119-142.
44. Noth, J. (1985). Neurophysiologische Aspekte der Muskelelastizität [Neurophysiological aspects of muscle elasticity]. Schriftreihe des Bundesinstituts fur Sportwissenschaft, 56, 238-253.
45. Prochazka, A., Schofield, P., Westerman, R.A., y Ziccone, S.P. (1977). Reflexes in cat ankle muscles after landing from falls. Journal of Physiology, 272, 705-719.
46. Rack, P.M.H., y Westbury, D.R. (1974). The short range stiffness of active mammalian muscle and its effect on mechanical properties. Journal of Physiology, 240, 331-350.
47. Roberts, T.J., Marsch, R.L., Weyand, P.G., y Taylor, C.R. (1997). Muscular force in running turkeys: The economy of minimizing work. Science, 275, 1113-1115.
48. Stein, R.B. (1982). What muscle variable(s) does the nervous system control in limb movements?. Behavioral and Brain Sciences, 5, 535-577.
49. Vallbo, AB. (1981). Basic patterns of muscle spindle discharge in man. In A. Taylor y A. Prochazka (Eds.). Muscle receptors and movement (pp. 263-275). London: Macmillan.
50. Voigt, M., Dyhre-Poulsen, P., y Simonsen, E.B. (1997). Modulation of short latency reflexes during human hopping. Manuscript submitted for publication.