Consideraciones Metabólicas de las Proteínas
Publicado 6 de abril de 2016, 8:50
El cuerpo humano depende de tres macronutrientes para producir energía, la cual es utilizada para el desarrollo de trabajo muscular y varias funciones celulares, incluyendo le reconstrucción y síntesis de nuevas células y tejidos. Particularmente, las proteínas son moléculas que se distinguen estructuralmente de los carbohidratos y las grasas por la presencia del grupo amino (NH2-). Además, a lo largo y ancho del cuerpo humano, las proteínas son omnipresentes y consideradas “moléculas de acción” dentro de la bioquímica. Las proteínas están compuestas de aminoácidos, 21 de los cuales son utilizados por cada célula del cuerpo para construir proteínas (recordemos que el aminoácido 21 es la L-selenocisteína, residuo común en la secuencia de algunas selenoproteínas (Figura 1). Incluso en el caso de algunos organismos unicelulares existe el aminoácido proteinogénico número 22 o pirrolisina).
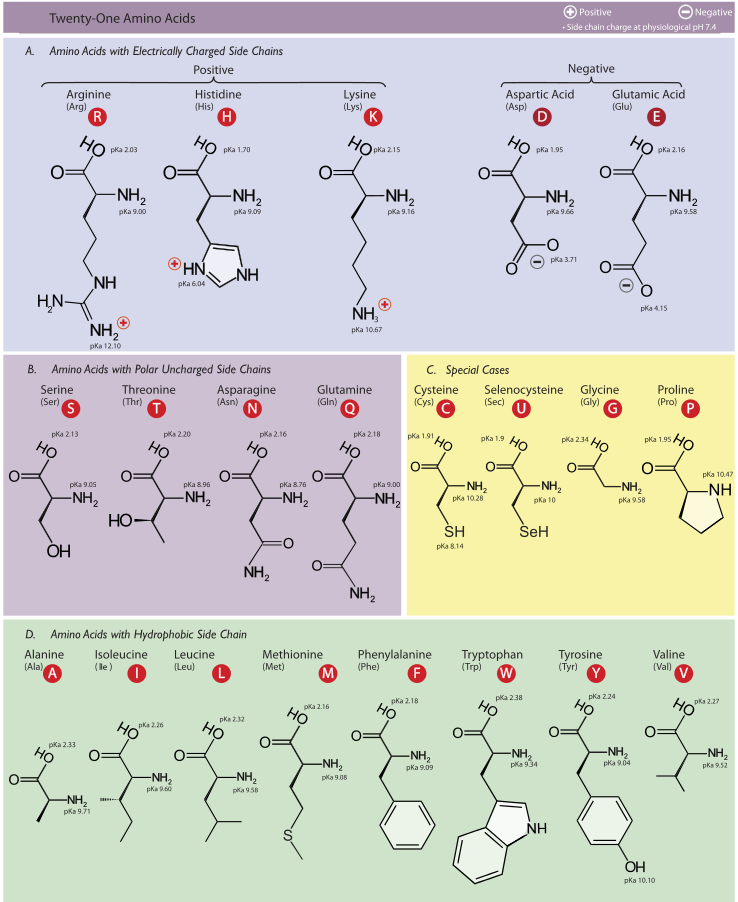
Figura 1. Estructuras Moleculares de los 21 Aminoácidos Proteinogénicos. Tomado de: Cojocarl D, Deparment of Medical Biophysics, University of Toronto, 2010.
A diferencia de los carbohidratos o las grasas, no existe un sistema de almacenamiento de proteínas en el cuerpo, de manera que la síntesis o degradación de proteínas va a incrementar o disminuir en respuesta a la demanda fisiológica (McLain TA, et al. 2015). Así, la proteína proveniente de la dieta es necesaria para que nuestro cuerpo pueda reparar, remodelar, sintetizar moléculas y construir estructuras intracelulares de alta relevancia metabólica. No obstante, los valores de ingesta diaria de proteína dietaria para un óptimo cuidado de la salud a largo plazo hacen parte de un tema controversial y de alto debate en la comunidad científica. Los estudios que han investigado los cambios fisiológicos y metabólicos durante el envejecimiento, pérdida de peso, reposo en cama y tratamientos para la diabetes tipo 2 o síndrome metabólico, han reportado beneficios de dietas con ingestas de proteína de 1.2-1.6 g / kg peso corporal o 20% de las necesidades energéticas (Layman DK, et al. 2015). Estas ingestas están por encima de las Nuevas Ingestas Recomendadas (Recommended Dietary Allowance, RDA) y contrario a estos reportes, hay estudios que no muestran beneficios de dietas altas en proteína; de hecho, en el 2010 el Dietary Guidelines Advisory Committee enunció que “la ingesta de proteína en los Estados Unidos es más que adecuada” e incluso el consumo inadecuado de proteína en Norteamérica es raro (Report of the Dietary Guidelines Advisory Committee on the Dietary Guidelines for Americans, 2010). De esta manera, estos puntos de vista divergentes provienen, al menos en parte, de definiciones de suficiencia/idoneidad proteica basados en medidas del balance de nitrógeno en comparación con la evaluación de los roles metabólicos de los aminoácidos individuales, lo cual como veremos más adelante presenta discrepancias.
Ahora bien, si incluimos la variable del entrenamiento y actividad física, los puntos en contra y a favor de diferentes propuestas nutricionales o ingestas diarias de proteína (excesiva o deficiente) son abrumadores, por lo cual parece ser que seguiremos defendiendo el consenso científico hasta que los datos “prometedores” de ciertos grupos de investigación alcancen el respaldo suficiente. Precisamente, los datos actuales sugieren que la ingesta de proteínas necesaria para soportar la adaptación metabólica, reparación, remodelamiento y recambio (turnover) proteico varían desde 1.2 hasta 2.0 g / kg / día. Incluso, ingestas mayores pueden ser recomendadas durante cortos periodos de entrenamiento intensificado o al momento de realizar restricciones calóricas (Metler S, et al. 2010; Philips SM, et al. 2011). Esto lleva a considerar que la ingesta diaria de proteína debe ser personalizada y cumplir, junto con un plan alimenticio correcto, la administración regular de aminoácidos desde cantidades moderadas de proteína de alta calidad a lo largo del día y, principalmente, luego de la sesión de entrenamiento vigoroso. Estas recomendaciones abarcan la mayoría de los regímenes de entrenamiento y permiten un ajuste flexible con la experiencia y entrenamiento periodizado (Rosenbloom & Coleman, 2012; Moore DR, et al., 2015). De hecho, la declaración conjunta (Joint Position Statement) de la American College of Sports Medicine, Academy of Nutrition and Dietetics, y Dietitians of Canada (2016), sostiene que aunque se brindan rangos generales diarios, los individuos ya no deben ser categorizados solamente como atletas de fuerza o resistencia ni tener una ingesta diaria de proteína rígida que no permita cambios. Por el contrario, las directrices dietarias deben estar basadas alrededor de las adaptaciones óptimas a las sesiones específicas de entrenamiento/competición dentro de un programa periodizado, apoyándose en un contexto macro de objetivos atléticos, necesidades específicas de nutrientes, consideraciones energéticas y gustos alimenticios.
Teniendo en cuenta la gran cantidad de datos nuevos y el desconocimiento de ciertos conceptos importantes en el metabolismo de las proteínas, a continuación explicaremos desde un punto de vista general, pero con suficiente profundidad bioquímica, algunos de ellos:
RECAMBIO “TURNOVER” PROTEICO
Una característica muy especial del metabolismo proteico es la existencia conjunta de procesos de síntesis y degradación de proteínas (Figura 2). Se produce un recambio o turnover. Este recambio es más rápido para las proteínas de la mucosa intestinal, de los eritrocitos o de la piel, y mucho menos para las proteínas del tejido conjuntivo y del sistema nervioso, por ejemplo. En cualquier caso, se puede considerar que el recambio proteico alcanza diariamente hasta un 2% del total de las proteínas del organismo, lo que se llama proteína corporal lábil (Álvarez L & Iglesias I, 2004).
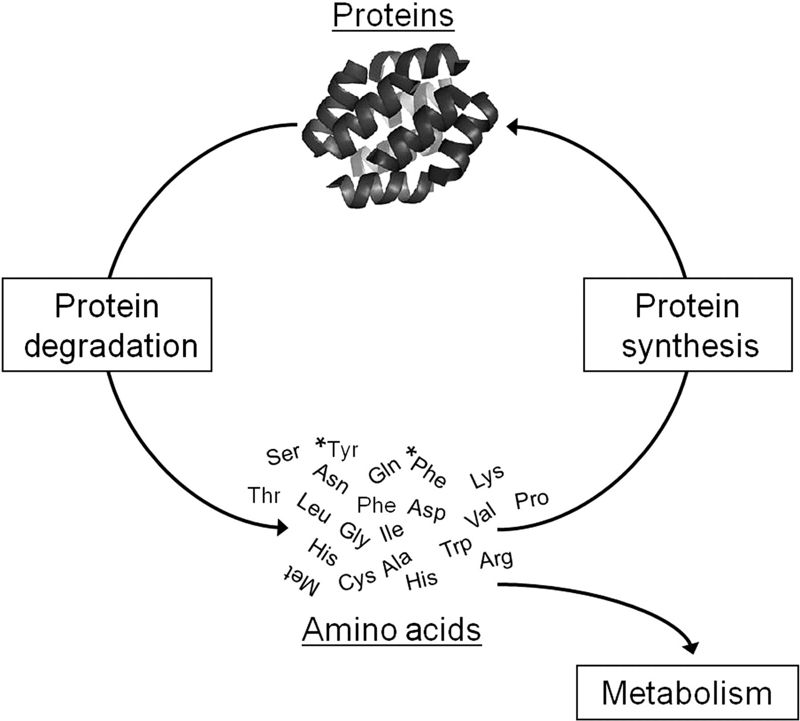
Figura 2. Turnover de Proteínas. El balance de la síntesis y degradación de proteínas determina el tamaño y función del miocito (célula muscular). Las proteínas dañadas, mal plegadas, con errores de síntesis o ya inútiles son degradas a aminoácidos, los cuales son utilizados para la síntesis de nuevas proteínas funcionales. Imagen tomado de: Baskin KK & Taegtmeyer H. Taking pressure off the heart: the ins and outs of atrophic remodelling. Cardiovasc Res. 2011, 90 (2): 243-250.
Aunque los efectos independientes de, bien sea, la ingesta energética o la proteína de la dieta sobre la composición corporal han sido estudiados extensivamente (al igual que el potencial energético, endocrino y los mecanismos metabólicos que explican las adaptaciones corporales a la manipulación dietaria de energía y proteína); la interacción entre el estado energético y la ingesta de proteína sobre el recambio proteico del músculo esquelético y los sistemas reguladores asociados permanecen ampliamente sin ser explorados. Estudios recientes de varios grupos de investigación han otorgado datos consistentes que demuestran efectos interactivos de la energía y proteína sobre el recambio de proteína muscular (Pasiakos SM, et al. 2015), lo cual explicaremos a continuación.
La mayor parte de los aminoácidos procedentes de la proteólisis (degradación de proteínas) vuelven a utilizarse en la resíntesis de las proteínas, aunque una parte significativa se cataboliza (entre un 15-20% del total), lo que obliga a su reposición dietética (Álvarez L & Iglesias I, 2004). Traducido a cifras para un hombre de 1.70 m de estatura y 70 kg de peso, las proteínas corporales constituyen alrededor de 11-12 kg y la proteína corporal lábil será de unos 240 g. Por tanto, la reposición dietética deberá superar unos 40 gramos (valor que corresponde al 15-20% que se cataboliza de esos 240 g de proteína lábil), es por eso que los requerimientos para un adulto normal se establecen un poco por encima de esta cantidad, alrededor de los 60 gramos.
Ahora bien, el turnover de proteínas del músculo esquelético es un proceso dinámico que abarca la síntesis de nuevas proteínas y la degradación de las existentes, pero la velocidad de este proceso dependerá de la disponibilidad de aminoácidos y la descomposición de proteína endógena. Como ya hemos comentado, el comportamiento cíclico de los aminoácidos entre la síntesis y degradación de proteína muscular es crítico para el crecimiento, mantenimiento y reparación de los tejidos corporales, lo cual facilita la adaptación y la recuperación luego de los mecanismos físicos que causan estrés metabólico (ej., rutina de hipertrofia) (Pasiakos SM, et al. 2015); por consiguiente, el mal funcionamiento de este recambio muscular puede ser un factor que contribuya a la pérdida progresiva de masa magra (ej., sarcopenia) (Murton AJ, 2015). El turnover muscular es regulado por señales anabólicas intracelulares y sistemas proteolíticos que se discuten con más detalle en las siguientes líneas:
- Regulación de la Síntesis de Proteína Muscular
Este proceso es mediado por la vía de señalización del complejo 1 del objetivo de rapamicina en mamíferos (mTORC1); en donde el estatus energético celular y la ingesta de proteína modulan su activación, traducción de mRNA y finalmente la síntesis de proteína muscular. De manera específica, la privación de energía facilita la activación de la proteína cinasa activada por AMP (AMPK), razón por la cual disminuye la señalización de mTORC1 y la síntesis de proteína muscular. Sin embargo, consumir proteína o una comida con macronutrientes promueve un incremento robusto del anabolismo proteico (Rosenbloom & Coleman, 2012). Dicha respuesta anabólica a la ingesta de proteína ocurre por el incremento postprandial en la disponibilidad extracelular de aminoácidos, la secreción de insulina y a la expresión de proteínas transportadoras de aminoácidos en el músculo (SNAT, LAT y otros discutidos en una próxima entrada). Esta secuencia de eventos permite un incremento intracelular de los niveles de aminoácidos, los cuales a su vez estimulan mTORC1 y sus objetivos corriente abajo p70S6K y la inactivación del represor de la traducción del mRNA, 4E-BP1 (Figura 3 - A). Las fuentes de proteína de la dieta que contienen altas concentraciones del aminoácido de cadena ramificada Leucina son particularmente efectivas para incrementar la síntesis de proteína muscular (de aquí radica la mayor proporción de Leucina en los suplementos de aminoácidos de cadena ramificada). La efectividad de la Leucina parece deberse a sus interacciones con la subfamilia de proteínas Rag (pequeñas GTPasas) y la subsecuente translocación lisosomal de mTORC1 (Pasiakos SM, et al. 2015).
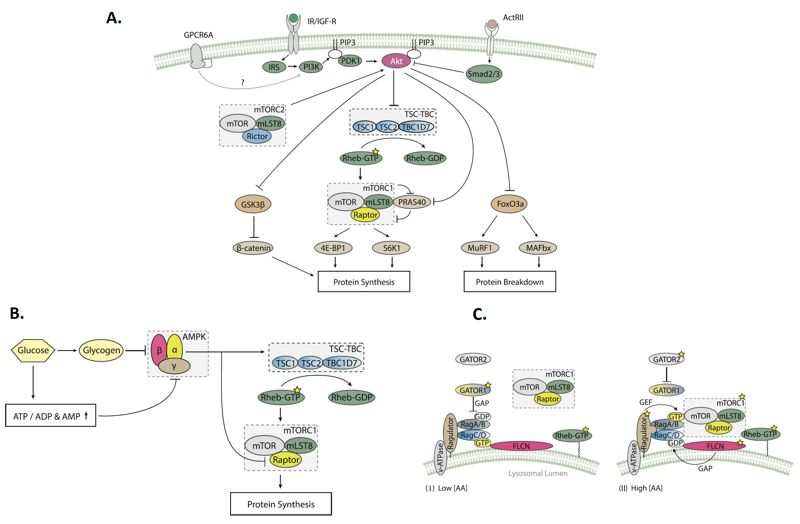
Figura 3. Puntos de regulación de la cascada de señalización mTORC1. A. Regulación de mTORC1 por factores de crecimiento. La activación de los receptores de insulina y el factor de crecimiento similar a la insulina 1 (IGF-1) permite la fosforilación de IRS el cual subsecuentemente activa alostéricamente PI3K. PI3K genera un producto lipídico conocido como PIP3, el cual recluta a PDK1 y Akt a la membrana plasmática. Akt, también conocida como PKB, es activada por PDK1 y mTORC2. Una vez activa, Akt inhibe varios sustratos, concretamente; el complejo TSC-TBC, el cual es un regulador negativo de mTORC1; GSK3β, el cual degrada a la β-catenina (proteína involucrada en la homeostasis del citoesqueleto y los polímeros de actina); FoxO3a el cual estimula MurF1 y MAFbx (relacionados con la atrofia muscular); y PRAS40 (sustrato de Akt de 40 kDa rico en prolina), el cual inhibe mTORC1. La activación de Akt es inducida por andrógenos, posiblemente por el incremento en la actividad de PI3K mediado por GPCR6A. Adicionalmente, la activación de Akt es inhibida por la activación de receptores de ActRII por medio del estímulo de Smad2 y Smad3 (proteínas relacionadas con las vías de remodelación inflamatoria de TGF-β). B. Regulación de AMPK por el estado energético. La subunidad γ de AMPK interactúa con los nucleótidos ATP, ADP y AMP. Un valor alto de la relación ATP/ADP& (lo que indica una buena condición energética de la célula) inhibe AMPL, mientras que una disminución de dicha relación activa esta importante regulador metabólico. Así, cuando la disponibilidad de energía de la célula es baja, AMPK está activa y fosforila a TSC2 en residuos de treonina y serina (Thr1227 y Ser1345), lo cual en paralelo con la fosforilación de Raptor (en residuos de serina 722 y 792) inhibe la actividad de mTORC1. C. Regulación de mTORC1 por aminoácidos. I. Las proteínas Rag se encuentran en estado inactivo durante bajas concentraciones de aminoácidos y, por tanto, son incapaces de reclutar a mTORC1 a la membrana lisosomal para su activación por Rheb-GTP (proteína homologa a Ras enriquecida en el cerebro, muy importante en la progresión del crecimiento y del ciclo celular). Las proteínas Ragulator y v-ATPase están en su estado inactivo, mientras GATOR1 ejerce su actividad GAP (proteína activadora de GTPasa) hacia RagA/B, asegurando el estado inactivo de estas Rags. II. Un incremento en la concentración de aminoácidos desencadena una cambio conformacional en v-ATPasa y Ragulator, la cual inicia su actividad como factor intercambiador de nucleótidos de guanina (GEF, Guanine nucleotide Exchange Factor) hacia RagA/B. Por su parte, foliculina (FLCN) y sus parejas de unión exhiben actividad GAP hacia RagC/D y de esta manera las activan también. Adicionalmente, la actividad GAP de GATOR1 es inhibida por GATOR2. Estos mecanismos sucesivos permiten la activación del heterodímero de RagA/B-ligado a GTP y RagC/D-ligado a GDP, lo cual en últimas promueve el reclutamiento de mTORC1 a la superficie lisosomal en donde puede ser activado por Rheb-GTP. Adaptado de: Bond P. Regulation of mTORC1 by growth factors, energy status, amino acids and mechanical stimuli at a glance. Journal of the International Society of Sports Nutrition, 2016, 13: 8
- Regulación de la Degradación de Proteína Muscular
La degradación de proteína muscular provee de los aminoácidos precursores para sostener el anabolismo proteico y además soporta la gluconeogénesis hepática. Son cuatro los sistemas proteolíticos que contribuyen al proceso de degradación proteica; incluyen, el Sistema Ubiquitina-Proteosoma (UPS, Ubiquitin Proteasome System), autofagia lisosomal, calpainas dependientes de calcio y las cisteín-proteasas, caspasas (Sandri M, 2013). El Sistema Ubiquitina-Proteosoma (UPS) es el mecanismo primario por el cual el tejido muscular es degradado, y en el cual nos centraremos en esta entrada. El UPS es un proceso altamente regulado e irreversible, que involucra un mecanismo dependiente de energía conocido como ubiquitinación de las proteínas musculares, a través de una serie de reacciones catalizadas por tres complejos enzimáticos diferentes. El proceso comienza con el clivaje miofibrilar dependiente de calpaina y caspasa 3, lo que genera fragmentos más pequeños y accesibles de actomiosina. Luego, estos fragmentos son marcados para su degradación por uniones covalentes de múltiples moléculas de ubiquitina mediante un proceso catalizado por enzimas E1 (enzima activadora de ubiquitina dependiente de ATP), E2 (enzima conjugadora de ubiquitina) y E3 (enzima ligasa de ubiquitina). La cadena de poliubiquitina es reconocida por el proteosoma 26S, un gran complejo proteolítico de varias subunidades que contiene un núcleo catalítico central (proteosoma 20S) y dos complejos reguladores terminales (complejos 19S). El complejo regulador 19S juega un papel central en el reconocimiento y desdoblamiento de las proteínas ubiquitiladas, de manera tal que las guía al núcleo catalítico 20S para la subsecuente hidrólisis proteica (Figura 4). La actividad y expresión del UPS se incrementa bajo condiciones de estrés metabólico y se piensa que incluso puede llegar a estar regulado por la vía de señalización mediada por insulina de mTORC1 (Pasiakos SM, et al. 2015).
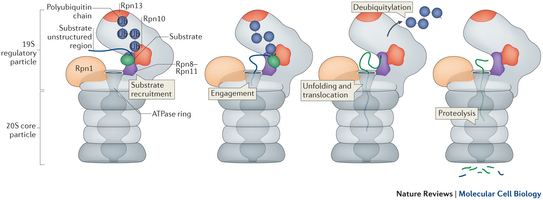
Figura 4. Acción del Proteosoma durante el Turnover Proteico. En la representación se muestran el complejo 20S y la zona reguladora 19S. Las zonas de color naranja corresponden a los sitios de reconocimiento de las cadenas de poliubiquitina que están ligadas a la proteína a degradar (Substrate Recruitment), la cual es guiada al centro del complejo 20S para su hidrólisis (Engagement). Posteriormente se llevan a cabo procesos de desubiquitinación una vez la proteína a catabolizar es desdoblada y translocada a través del núcleo del complejo 20S, en donde finalmente sufrirá la proteólisis. Figura tomada de: Bhattacharyya S, et al. Nature Reviews Molecular Cell Biology, 2014, 15: 122–133.
El proteosoma es un componente esencial en el sistema de control de calidad de las proteínas. Su inhibición es letal, debido a que permitiría la acumulación de proteínas sin degradar, las cuales son potencialmente tóxicas, además de generar un desbalance de aminoácidos debido a que dichas proteínas sin degradar inmovilizarían el reciclaje normal de aminoácidos (Baumann K, 2014).
Teniendo en cuenta los párrafos anteriores, la figura 5 se fundamenta por sí sola y nos representa un resumen macro de lo que ya ha sido discutido bioquímicamente.
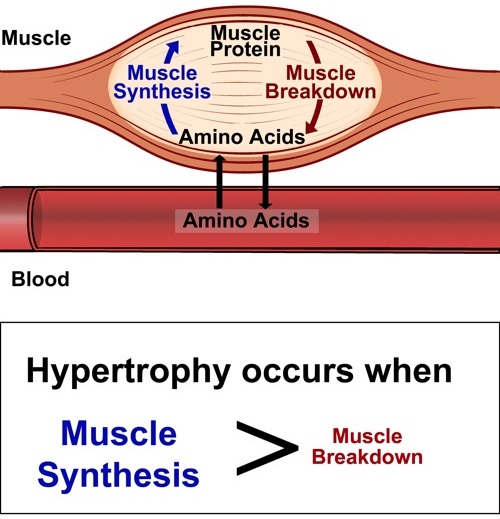
Figura 5. Representación esquemática de la degradación y síntesis de proteínas. De manera general, podemos decir que la hipertrofia muscular ocurre cuando la tasa de síntesis de proteína muscular es mayor a la degradación de la misma. Debemos tener en cuenta la importancia del aporte calórico necesario para la correcta utilización de los esqueletos nitrogenados (100-200 kcal por cada gramo de nitrógeno - Lemon PW, 1991).
BALANCE CORPORAL DE NITRÓGENO
Las ingestas recomendadas de proteína para un adulto normal se pueden establecer en aproximadamente entre 0.8 g por kilogramo por día. Naturalmente, los requerimientos son mucho mayores para recién nacidos, niños, embarazadas, deportistas/atletas, etc., y menores en las últimas etapas de la vida (Dietary Guidelines Advisory Committee, 2010).
Estos requerimientos están basados en las consideraciones expuestas anteriormente pero se establecen de una manera práctica, valorando la ingesta y las pérdidas entre (heces, orina, sudor, descamación de piel y mucosa intestinal, pelo, etc.) se llega así a lo que se denomina balance corporal de nitrógeno que es la diferencia entre ambas magnitudes (Álvarez L & Iglesias I, 2004). Dicho de otro modo, considerando que el contenido medio de nitrógeno en las proteínas de la dieta está estimado en un 16%, por medio de la relación entre el consumo de proteínas desde la dieta, y su eliminación desde el organismo, puede establecerse un balance de nitrógeno retenido (Nacleiro, et al., 2011).
Este balance es positivo cuando la ingesta supera las pérdidas, e indica un mayor “anabolismo proteico” porque el organismo retiene nitrógeno que en exceso estimula la síntesis proteica en las células del organismo (Poortmans JR, 1993; Di Pasquale M, 1997; Tipton & Wolf, 2001). Se produce cuando hay crecimiento o recuperación de una enfermedad. Por otro lado, cuando las pérdidas superan a la ingesta estamos ante un balance negativo (situaciones de ayuno, estrés, etc.); es decir, cuando se excreta más nitrógeno del que se consume, e indica un elevado “catabolismo proteico” (McArdle, et al. 2000). El balance cero o equilibrio nitrogenado caracteriza al adulto normal.
- ¿Acaso estamos entrando en un nuevo paradigma nutricional? ¿Por qué aún no se reevalúan las RDA?
El balance de nitrógeno es la medida convencional de las necesidades proteicas utilizada para confeccionar las RDA, y refleja la eficiencia de retención de nitrógeno bajo condiciones de balance energético. En este contexto, la ingesta de proteína por encima de los requerimientos establecidos para tener un correcto balance nitrogenado, ha sido vista como innecesaria y posiblemente insegura. Como ya se mencionó, la RDA para hombres y mujeres (19 años) es de 0.80 g de proteína de alta calidad por kilogramo de peso corporal por día, y está basada en el requerimiento mínimo proteico para alcanzar el balance de nitrógeno. Las pérdidas de nitrógeno reflejan el requerimiento diario a reemplazar de aminoácidos esenciales perdidos en vías de degradación y son estimadas a través de la colección de nitrógeno en orina, heces, respiración, piel y cabello, y extrapoladas a proteína dietaria. Para la estimación de la RDA, o más específicamente, el Requerimiento Medio Estimado (EAR, Estimated Average Requirement), la proteína dietaria es valorada como la cantidad mínima que le permita al cuerpo conseguir el balance nitrogenado y usa una regresión monolinear para calcular el punto de cambio para EAR (Layman DK, et al. 2015). Esto representa una tasa obligatoria de degradación de aminoácidos; sin embargo, esta tasa de pérdida de nitrógeno no tiene relación directa con otros roles metabólicos de los aminoácidos. Así, el planteamiento del balance de nitrógeno tiene como suposición inherente que los objetivos dietéticos para la ingesta de proteína son equiparables a la eficiencia de utilización de aminoácidos en las moléculas que contienen nitrógeno solamente. Este enfoque singular de alcanzar la oxidación de aminoácidos más baja posible sugiere que un aumento de las concentraciones intracelulares de aminoácidos, o sus esqueletos carbonados de cetoácidos, es innecesario e incluso desfavorable. Aunque la RDA puede representar el mínimo requerido de aminoácidos para la mayoría de individuos saludables, ingestas mayores de aminoácidos esenciales pueden otorgar beneficios metabólicos, incluyendo una mejora en la composición corporal (ej., mantenimiento, crecimiento o función de la masa magra), incrementar la saciedad, aumentar la termogénesis o mejorar la regulación de la glucemia, además de contribuir a la recuperación luego de un trauma, cirugía o descanso en cama prolongado (Lemon PW, 1991; Murton AJ, 2015; Pasiakos SM, et al. 2015). Variables relacionadas con la masa muscular, fuerza y la función metabólica también han sido propuestas como otros puntos relevantes (Layman DK, et al. 2015).
Por otro lado, una propuesta alternativa al balance de nitrógeno es utilizar un trazador isotópico como indicador de la oxidación de aminoácidos (IAAO, Indicator Amino Acid Oxidation). El método IAAO está basado en el concepto que cuando un aminoácido esencial está deficiente, todos los demás aminoácidos (incluyendo el marcador isotópico del aminoácido) serán oxidados. A medida que la ingesta del aminoácido deficiente o limitante incrementa, la tasa de oxidación de los otros aminoácidos descenderá en tanto más aminoácidos son incorporados a proteínas. El método IAAO usa una regresión bifásica para calcular el punto de cambio para EAR, y presuntamente refleja la cantidad mínima de proteína necesaria para crear una saturación del ARN transferente (tARN) para la síntesis proteica. El punto de más baja oxidación del aminoácido indicador es definido como el requerimiento del aminoácido limitante. Estudios realizados con el método IAAO han demostrado que los requerimientos proteicos puede llegar a ser de ≈ 1.2 g / kg / día, valor que es 40-50% más alto que el balance de nitrógeno y la RDA actual (Humayn MA, et al. 2007; Elango R, et al. 2008; Fukagawa NK, 2014; Marini JC, 2015; Layman DK, et al. 2015).
“CADA INTENTO DE HACER UN GRAN CAMBIO A LAS CONDICIONES EXISTENTES, CADA NOBLE VISIÓN DE NUEVAS POSIBILIDADES PARA LA RAZA HUMANA, HA SIDO ETIQUETADO DE UTOPÍA” – Emma Goldman
CAPACITACIÓN RECOMENDADA:
Actualización en Suplementación Pre, Intra & Post-Entrenamiento
Por Diego A. Bonilla Ocampo
MTX NUTRITION Science Product Manager
MTX COLLEGE Director
REFERENCIAS
1. Tipton KD & Wolf R. Exercise, Protein Metabolism and Muscle Growth. Int J Sport Nutrition and Exc Metab. 2001, 11 (1): 109-132.
2. Poortmans, JR. Principles of Exercise Biochemistry, Karger, 1993.
3. Di Pasquale, M. Amino Acids and Protein for the Athletes, The Anabolic Edge. CRC Press Boca Raton New York, 1997.
4. Mettler S,Mitchell N, Tipton KD. Increased protein intake reduces lean body mass loss during weight loss in athletes. Medicine and Science in Sports and Exercise. 2010; 42 (2): 326–337.
5. Phillips SM, Van Loon LJ. Dietary protein for athletes: from requirements to optimum adaptation. Journal of Sports Sciences. 2011; 29 (Suppl 1): S29–38.
6. Rosenbloom CA, Coleman EJ. Sports Nutrition: A Practice Manual for Professionals. Academy of Nutrition & Dietetics; 2012.
7. Moore DR, Phillips SM, Slater G. Protein. In: Deakin V, Burke L, eds. Clinical Sports Nutrition. 5th ed: McGraw-Hill Education, 2015: 94–113.
8. American College of Sports Medicine; American Dietetic Association; Dietitians of Canada. Joint Position Statement: Nutrition and Athletic Performance. Medicine & Science in Sports & Exercise. 2016, 116 (3): 501-528.
9. Mcardle W, Katch FI, Katch VL. Essentials of Exercise Physiology, 2º Edition Lippincott Williams & Wilkins, 2000.
10. Álvarez L & Iglesias I. Asignatura; Avances en Alimentación y Nutrición. Biblioteca Fundación Universitaria Iberoamericana, 2004.
11. Dietary Guidelines Advisory Committee. Report of the Dietary Guidelines Advisory Committee on the Dietary Guidelines for Americans, 2010, to the Secretary of Agriculture and the Secretary of Health and Human Services. Washington (DC): US Department of Agriculture, Agricultural Research Service; 2010.
12. Bauer J, Biolo G, Cederholm T, Cesari M, Cruz-Jentoft A, Morley J, Phillips S, Sieber C, Stehle P, Teta D, et al. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. J Am Med Dir Assoc 2013; 14: 542–59.
13. Layman DK, Anthony TG, Rasmussen BB, Adams SH, Lynch CJ, Brinkworth GD & Davis TA. Defining meal requirements for protein to optimize metabolic roles of amino acids. Am J Clin Nutr 2015; 101 (Suppl): 1330S–1338S.
14. Bhattacharyya S, Yu H, Mim C & Matouschek A. Regulated protein turnover: snapshots of the proteasome in action. Nature Reviews Molecular Cell Biology, 2014, 15: 122–133.
15. Pasiakos SM, Marolis LM & Orr JS. Optimized dietary strategies to protect skeletal muscle mass during periods of unavoidable energy deficit. FASEB Journal. 2015, 29: 1136–1142.
16. Baumann K. Protein Metabolism; How the Proteosome adapts to Stress. Nature Reviews Molecular Cell Biology, 2014, 15: 562–563
18. McLain TA, Escobar KA & Kerksick CM. Protein Applications in Sports Nutrition—Part I: Requirements, Quality, Source, and Optimal Dose. Strength and Conditioning Journal, 2015. 37 (2): 61-71.
19. Bond P. Regulation of mTORC1 by growth factors, energy status, amino acids and mechanical stimuli at a glance. Journal of the International Society of Sports Nutrition, 2016, 13: 8 DOI 10.1186/s12970-016-0118-y
20. Murton AJ. Muscle protein turnover in the elderly and its potential contribution to the development of sarcopenia. Proceedings of the Nutrition Society, 2015, 74: 387–396.
21. Humayun MA, Elango R, Ball RO & Pencharz PB. Reevaluation of the protein requirement in young men with the indicator amino acid oxidation technique. Am J Clin Nutr, 2007; 86 (4): 995-1002.
22. Dietary Guidelines Advisory Committee. Report of the Dietary Guidelines Advisory Committee on the Dietary Guidelines for Americans, 2010, to the Secretary of Agriculture and the Secretary of Health and Human Services. Washington (DC): US Department of Agriculture, Agricultural Research Service; 2010.
23. Baskin KK & Taegtmeyer H. Taking pressure off the heart: the ins and outs of atrophic remodelling. Cardiovasc Res. 2011, 90 (2): 243-250.
24. Heinrichs A. Cell signalling: Of Rags and Ragulator. Nature Reviews Molecular Cell Biology, 2010, 11: 388–389.
25. Sancak Y, Bar-Peled L, Zoncu R, Markhard AL, Nada S, Sabatini DM. Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids. Cell, 2010, 141 (2): 290-303.
26. Sandri M. Protein breakdown in muscle wasting: role of autophagy–lysosome and ubiquitin–proteasome. Int J Biochem Cell Biol, 2013, 45: 2121–2129.
27. Lemon PW. Protein and amino acid needs of the strength athlete. Int J Sport Nutr, 1991, 1: 127-145.
28. Elango R, Ball R & Pencharz P. Indicator amino acid oxidation: concept and application. J Nutr, 2008, 138: 243–6.
29. Fukagawa NK. Protein requirements: methodologic controversy amid a call for change. Am J Clin Nutr, 2014, 99 (4): 761-762.
30. Marinin JC. Protein Requirements: Are We Ready for New Recommendations? J Nutr, 2015, 145 (1): 5-6.
