Suplementación con Cafeína - Serie Uno; Metabolismo
Publicado 9 de mayo de 2014, 0:18
1. Características Generales
La cafeína es un alcaloide, también conocida como 1,3,7-trimetilxantina, la cual que se encuentra en ciertas plantas, notablemente en Camelia sinensis, coffea sp., Theobroma cacao L. y bebidas derivadas de éstas. Bioquímicamente, se la considera un antagonista de los receptores de adenosina A1 y A2, un inhibidor de la fosfodiesterasa y un estimulante del sistema nervioso central, que afecta el sistema cardiovascular y produce diuresis. Sus acciones son similares a las de la teofilina, pero menos potentes [1].
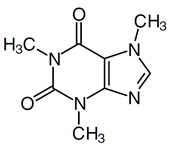
Figura 1. Estructura química de la Cafeína
La cafeína es la droga recreacional más ampliamente usada en el mundo, así que es difícil evaluar su efecto de manera aislada; por lo tanto, diferentes grupos de investigación han estudiado sus efectos a partir de la ingesta de café o bebidas con cafeína. Su popularidad se debe principalmente a sus efectos psicoactivos y levemente disociativos, aunque también es utilizada como un analgésico adyuvante en combinación con medicamentos anti-inflamatorios no esteroideos y paracetamol (acetaminofén) [2]. Además, de la mayoría de suplementos dietarios etiquetados para “perder peso” muchos incorporan una combinación de ingredientes que incluyen cafeína. Recientemente, algunos estudios han sugerido que la cafeína tiene un importante rol neuroprotector con un potencial tratamiento para el Parkinson [3], además de exhibir un efecto inhibidor de la acumulación de lípidos en hepatocitos [4]. Estos y muchos otros aspectos relacionados con el metabolismo de la cafeína serán analizados en una serie de Blogs que tendrán como objetivo evaluar la verdadera eficacia de la suplementación con Cafeína en el ser humano.
2. Metabolismo
La cafeína es casi completamente metabolizada, siendo solamente un 3% o menos excretada sin cambios en la orina. De hecho, la ruta principal del metabolismo de la cafeína en humanos (70-80%) es la vía de desmetilación en el nitrógeno 3 (3-N-demethylation) para producir paraxantina, también como conocida como 1,7-dimetilxantina o 17X [5]. Esta reacción es llevada a cabo por el citocromo P450 1A2 (CYP1A2) en el hígado. Experimentos con microsomas hepáticos humanos estiman que la desmetilación en 1-N para producir teobromina representa aproximadamente 7-8% del metabolismo de la cafeína, de la misma manera que la desmetilación en 7-N para producir teofilina se encuentra en una tasa entre 7-8%. El 15% restante de la cafeína sufre una hidroxilación en C-8 para formar ácido 1,3,7-trimetilúrico.
CYP1A2 es responsable de más del 95% del metabolismo primario de la cafeína. Por lo tanto, la cafeína es usada como un medicamento prueba para analizar la actividad de CYP1A2, con las tasas relativas de metabolitos excretados en la orina como un indicador del flujo a través de las diferentes partes de la vía. Además de paraxantina, los principales metabolitos en la orina provenientes de la cafeína son 1-metilxantina, ácido 1-metilúrico, 5-acetilamino-6-formilamino-3-metiluracilo (AFMU) y ácido 1,7-dimetilúrico. Éstos son formados por el metabolismo secundario de la paraxantina a través de la acción de CYP1A2, CYP2A6, N-acetiltransferasa 2 (NAT2) y xantina oxidasa (XDH). Estudios in vitro en líneas celulares muestran un involucramiento de CYP2E1 en la formación de teobromina y teofilina, mientras que estudios con proteínas recombinantes en microsomas no soportan dicha apreciación y en vez de eso sugieren que dicha isoenzima contribuye a la formación de ácido 1,3,7-trimetilúrico. Igualmente, experimentos con microsomas han mostrado que otras isoenzimas de sistema enzimático del citocromo P450 oxidasa también participan en el metabolismo primario de la cafeína (ej. CYP2C8, CYP2C9 y CYP3A4). La figura 2 muestra los principales genes involucrados en el metabolismo de la cafeína y los productos predominantes de dicho proceso.
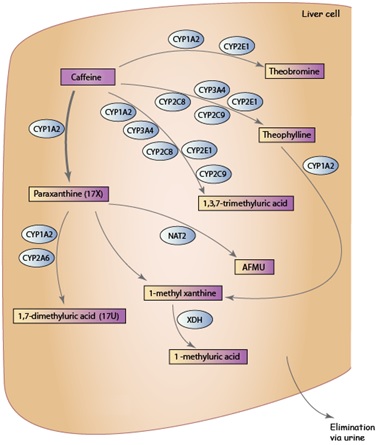
Figura 2. Genes relacionados con el metabolismo de la Cafeína en seres humanos. Tomado de: http://www.pharmgkb.org/pathway/PA165884757
La cafeína tiene una vida media de 4 – 5 horas, la cual puede prolongarse en pacientes con enfermedades hepáticas, infantes y neonatos (hasta más de 100 horas), o durante el embarazo. Por otro lado, fumar incrementa la excreción de cafeína debido a las acciones estimulantes de la nicotina y otros componentes del cigarrillo sobre CYP1A2 [6]. Ahora bien, la administración de cafeína ha mostrado incrementar de una manera dosis dependiente el metabolismo energético basal en humanos adultos sanos y con sobrepeso. A pesar de los datos conflictivos que se presentan en la actualidad, se ha aceptado de manera general que la cafeína estimula efectivamente el sistema nervioso central e incrementa el metabolismo basal en humanos. Pero, ¿de dónde provienen éstos efectos fisiológicos?
Una vez la cafeína alcanza el torrente sanguíneo pasa rápidamente a los tejidos periféricos y al cerebro, ya que no se acumula en sangre ni se almacena en el organismo. Al encontrarse en el interior de la célula cumple con su primer rol metabólico al inhibir competitivamente la fosfodiesterasa (PDE), enzima que degrada el AMP cíclico (AMPc). De esta manera, la ingesta de cafeína permite una acumulación de AMPc, el cual es un segundo mensajero típico de vías metabólicas ligadas a receptores de membrana acoplados a proteína G y considerado un excitador metabólico celular. Dicha apreciación se debe a que una vez se incrementa la concentración de AMPc en el citoplasma, se activa la proteína cinasa dependiente de AMPc (PKA), la cual activa corriente abajo una serie de enzimas reguladoras y factores de transcripción (ej. AMPK y CREB) que en últimas incrementan el gasto energético (aumentan el metabolismo basal) y la oxidación de ácidos grasos. La figura 3 describe los fenómenos fisiológicos descritos anteriormente.
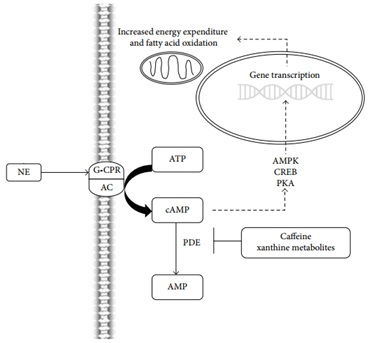
Figura 3. Efecto de la cafeína sobre la fosfodiesterasa y el metabolismo energético basal. La cafeína y sus xantinas derivadas inhiben la degradación de AMPc, al actuar como antagonista competitivo de la fosfodiesterasa. Un incremento de AMPc intracelular activa PKA y su cascada de señalización, lo cual estimula la activación de AMPK, CREB y otros reguladores energéticos celulares. Abreviaciones: norepinefrina (NE), receptor acoplado a proteína G (GCPR), adenilato ciclasa (AC) y fosfodiesterasa (PDE). Tomado de [7].
Paralelamente, al alcanzar y cruzar la barrera hematoencefálica, la cafeína actúa como antagonista de receptores adrenérgicos A1 y A2, lo cual detiene el efecto inhibidor de la adenosina sobre el sistema nervioso central. Esto causa que la actividad cerebral sea mayor que la línea base; a medida que el cerebro es estimulado, más dopamina, norepinefrina y glutamato (neurotransmisores estimulantes) son liberados, lo cual explica los efectos estimulantes de la cafeína (Ver figura 4).
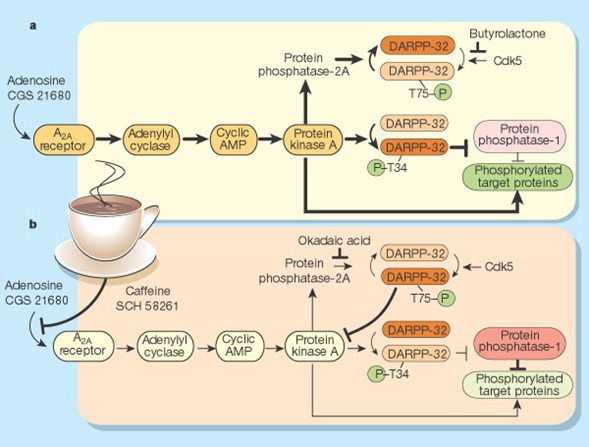
Figura 4. Mecanismo que explica como la cafeína “despierta” las neuronas, basado en el trabajo de Lindskog et al. A. Ausencia de cafeína. Tras la activación de los receptores adrenérgicos 2A, la adenosina incrementa la actividad de la adenilato ciclasa, permitiendo la formación de AMPc y la activación de PKA. Esta enzima activa la proteína fosfatasa 2A, la cual permite la desfosforilación de la fosfoproteína neuronal regulada por dopamina y AMPc (DARPP-32) en el residuo de treonina 75 (T75). PKA también fosforila otras proteínas. Finalmente, ésta fosforila a DARPP-32 en T34, permitiendo la inhibición de proteína fosfatasa 1, lo cual impide la desfosforilación de otros objetivos proteicos. B. El bloqueo parcial de los receptores adrenérgicos 2A por bajas concentraciones de cafeína reduce la formación de AMPc y la activación de PKA, al mismo tiempo que se disminuye la activación de proteína fosfatasa 2A. El incremento en el estado de fosforilación de DARPP-32 en T75 convierte a ésta proteína en un inhibidor de PKA. Lo anterior amplifica los efectos de la cafeína a través de un ciclo de reacciones positivo (positive feedback loop). CGS 21680, butirolactona, ácido okadaico y SCH 58261 son drogas que fueron usadas por Lindskog et al. para estudiar estas vías de señalización. Las flechas y barras más gruesas y oscuras indican mayores niveles de actividad. Tomado de [8].
Otro segundo mensajero que incrementa considerablemente su concentración tras el ingreso de cafeína a la célula es el ión calcio (Ca2+). Primero debemos tener claro que los receptores de rianodina (RyRs) son el mayor mediador celular de la liberación de Ca2+ mediada por Ca2+ (calcium-induced calcium release - CICR), siendo el principal canal de Ca2+ que se encuentran en varios tejidos excitables como el muscular y el neuronal. Ahora bien, entre sus principales agonistas se encuentra las xantinas, como la cafeína, quienes activan los RyRs al potenciar la sensibilidad al Ca2+ intracelular. De hecho, concentraciones en el rango milimolar son suficientes para activar los RyRs, por lo que altas concentraciones de cafeína (5 mmol/L) causan un incremento pronunciado (desde micromolar a picomolar) en la sensibilidad de los RyRs al Ca2+, de manera que las concentraciones basales de Ca2+ se vuelven activadoras del proceso a través de CICR. Recordemos que el Ca2+ es un segundo mensajero de fundamental importancia en el metabolismo humano, ya que regula procesos como la contracción muscular, el metabolismo energético, apoptosis, proliferación, fertilización, aprendizaje y memoria, exocitosis, entre muchas otros [10]. De ésta manera, es común encontrar en investigaciones científicas relacionadas con la fisiología muscular y el rendimiento deportivo la inclusión de cafeína como potenciador de Ca2+ citoplasmático y el análisis diferencial de éste último como indicador de daño celular o la intervención de otras posibles vías metabólicas reguladas por éste ión [11].
Teniendo claras las rutas metabólicas más conocidas que se relacionan directamente con la administración de cafeína, en nuestro próximo blog abordaremos los efectos principales y aquellos mitos ligados a la suplementación con cafeína desde tres macro-puntos de vista; el rendimiento deportivo, el rendimiento cerebral y el rendimiento cardiovascular.

REFERENCIAS
[1] Cammack R. (2006). Oxford Dictionary of Biochemistry and Molecular Biology - Revised Edition. Oxford UniversityPress.
[2] Sawynok J. (2011). Methylxanthines and pain.HandbExpPharmacol(200):311-329
[3]. Prediger RD. (2010). Effects of caffeine in Parkinson's disease: from neuroprotection to the management of motor and non-motor symptoms.J AlzheimersDis.20 Suppl 1: S205-220
[4] Hai Yan Quan, Do Yeon Kim & Sung Hyun Chung. (2013). Caffeine attenuates lipid accumulation via activation of AMP-activated protein kinase signaling pathway in HepG2 cells. BMB Reports 2013; 46(4): 207-212
[5] Kot M & Daniel WA.(2008). Caffeine as a marker substrate for testing cytochrome P450 activity in human and rat.Pharmacol Rep. Nov-Dec;60(6):789-797.
[6] Faber MS & Fuhr U. (2004). Time response of cytochrome P450 1A2 activity on cessation of heavy smoking. Clin Pharmacol Ther. Aug;76 (2): 178-184.
[7] Vaughan RA, Conn CA & Mermier CM. (2014). Effects of Commercially Available Dietary Supplements on Resting Energy Expenditure: A Brief Report. ISRN Nutrition Volume 2014, Article ID 650264, 7 pages
[8] Vaugeois JM. (2002). Signal transduction: Positive feedback from coffee. Nature 418, 734-736
[9] http://www.pharmgkb.org/pathway/PA165884757#tabview=tab0&subtab=
[10] Krebs J & Michalak M. (2007). Calcium: A Matter of Life or Death. Elsevier ISBN: 978-0-444-52805-6, Italy.
[11] Bonilla DA. (2013). Principios Metabólicos de los Efectos de la Suplementación con Creatina sobre el Rendimiento Deportivo. PubliCE Standard. http://g-se.com/es/org/db-sport-supplementation/articulos/principios-metabolicos-de-los-efectos-de-la-suplementacion-con-creatina-sobre-el-rendimiento-deportivo-1601
