Mecanismos cerebrales de la Obesidad; Neurociencias para la Actividad Física.
Publicado 6 de julio de 2016, 22:17
Una pincelada sobre la Obesidad
En la actualidad la obesidad es reconocida como una epidemia que afecta a millones de personas en el mundo, con efectos directos sobre la salud, pero también múltiples efectos indirectos al ser el terreno sobre el cual surgirán las enfermedades metabólicas (diabetes) y las cardiovasculares (cardiopatías y accidente cerebro vascular).
En el año 2008, 1500 millones de adultos tenían sobrepeso, de los cuales 200 millones de hombres y 300 millones de mujeres eran obesos. En el año 2010 se calculaba que 43 millones de niños menores de 5 años tenían sobrepeso (OMS, 2011a).
El sobrepeso, que es cuando el peso corporal excede al de referencia (Chavarria Arciniega et al, 2002), puede significar un aumento de grasa corporal, aunque no necesariamente es así siempre, como sucede en el caso de algunos deportistas, que puede deberse a un aumento de masa muscular. Pero la obesidad sí implica el exceso de grasa corporal, conllevando riesgos en la salud, debido a un aumento en el número de células adiposas y/ó en su volumen. Se la puede considerar una enfermedad caracterizada por crear las condiciones para la aparición de diferentes comorbilidades como la hipertensión arterial, la arteriosclerosis y enfermedad cardiovascular, la osteoartritis y la diabetes tipo II, entre otras.
Sin dejar de mencionar aspectos psicológicos relacionados como la pérdida de la autoestima, inseguridad, angustia que pueden generar un círculo vicioso y reforzar las conductas patológicas. A nivel social produce una minusvalía que conlleva a dejar de realizar actividades diarias, recreativas, deportivas. Aquí es donde aparecen con más fuerza las conductas sedentarias que sólo agravan aún más el problema.
La actividad física puede colaborar en el descenso del peso corporal así como en la reducción del porcentaje graso con aumento de la masa magra. La frecuencia y duración de las sesiones de ejercicio están relacionadas con el proceso de modificación de la composición corporal y su mantenimiento en el tiempo.
La actividad física para la pérdida de peso debe estar asociada a pautas alimenticias adecuadas con reducción de la ingesta calórica. Es importante recalcar que los individuos obesos que realizan actividad física tienen una morbimortalidad 30% menor con respecto a sus pares sedentarios y al comparar obesos entrenados con sedentarios delgados esta relación se mantiene.
Los estudios confirman que la efectiva prescripción de la actividad física reduce los índices de obesidad, además, en referencia a las causas de la obesidad, la OMS atribuye como causa fundamental del sobrepeso y la obesidad al desequilibrio energético -entre calorías consumidas y gastadas- ocasionado por los cambios en los hábitos de alimentación y actividad física, que son atribuidos a cambios ambientales y sociales asociados al desarrollo y falta de políticas de apoyo en sectores como la salud, la educación entre otros, sin embargo ¿qué sabemos de la obesidad desde el punto de vista de la neurociencia?
Cerebro, hambre y obesidad
Las investigaciones sobre la obesidad y su relación con el cerebro han aumentado de manera considerable en los últimos tiempos generando varias conclusiones que han sobrepasado algunas barreras científicas y generando nuevas hipótesis que con el tiempo seguramente las confirmaremos o negaremos.
Considerar factores internos como el hambre, la sobrealimentación y su relación con el cerebro, pueden ofrecernos un punto de partida estructural para entender la problemática de la obesidad en un primer plano.
Entonces ¿Qué causa el hambre? Las primeras hipótesis sobre el hambre y la sobrealimentación iniciaron con en los estudios de Cannon y Washburn en el año 1912, donde concluyeron que “el hambre no es más que las contracciones de un estómago vacío”, ahora sabemos que existen diversas causas que contribuyen a este fenómeno. Muchos factores se combinan para promover y suprimir el hambre (Ribeiro et al., 2009). Estudios muestran que las personas a las que se les ha quitado el estómago por razones médicas siguen sintiendo hambre y comiendo con regularidad (Woods et al, 2000), ante estos resultados, resulta primordial explorar los mecanismos de la conducta alimentaria que potencian la sobrealimentación.
Como todo comportamiento, la conducta alimentaria es la respuesta a complejos mecanismos de elaboración en el cerebro y su interacción con otros sistemas del organismo. Desde este contexto, es poco efectivo afirmar consistentemente que el hambre es sólo una necesidad homeostática; que la sobrealimentación es únicamente un exceso de la ingesta; y que la obesidad se debe sólo a un desequilibrio entre la ingesta y el gasto calórico, estudios han demostrado que el problema tiende a ir más allá, vamos a explorar un poco que nos dice la neurociencia al respecto.
¿Qué parte del cerebro controla el hambre? Aunque no existe un único “regulador del hambre”, una pequeña área llamada hipotálamo es especialmente importante a este respecto, porque regula muchos motivos, entre ellos el hambre, y la sed (*figura 1). El hipotálamo es sensible al nivel de azúcar en la sangre (así como de otras sustancias). Recibe asimismo mensajes neurales de los sistemas endócrino y digestivo. Cuando se combinan, estas señales hacen que tengas hambre (Freberg, 2010; Woods et al., 2000). Otro punto importante es el circuito de recompensa que también juega un papel fundamental al momento de diferenciar la alimentación energética -la que tu organismo necesita para sobrevivir- con la hedónica (la que comes por placer incluso cuando te encuentras saciado).
Experimentos realizados en animales han demostrado que el hipotálamo juega un papel fundamental en la regulación del “apetito” y la “saciedad”, debido a estos efectos independientes, los expertos propusieron un sistema de regulación en dos sentidos, con un centro de control de la saciedad por un lado y un centro de control del hambre por otro.
En el hipotálamo se desarrolla una lucha homeostática entre el apetito (hambre) y la saciedad.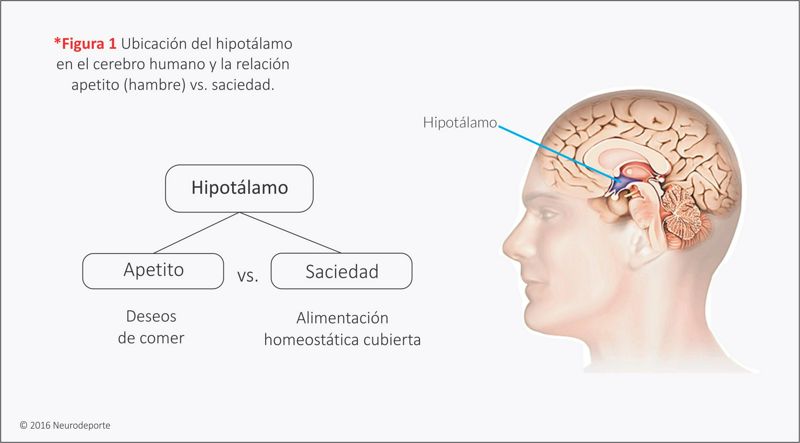
Una parte del hipotálamo actúa como un sistema de alimentación, el cual da inicio al comer. Si el hipotálamo lateral se “enciende”, incluso un animal bien alimentado empezará a comer de inmediato. (El término lateral se refiere simplemente a los lados del hipotálamo. Consulta (*figura 2). Si esa misma área se destruyera, el animal podría no volver a comer nunca más.
El hipotálamo lateral normalmente es activado de varias maneras. Por ejemplo, cuando tienes hambre, las paredes de tu estómago producen grelina, una hormona que activa tu hipotálamo lateral (Castañeda et al., 2010; Olszewski et al., 2003). (Si tu estómago gruñe, probablemente está liberando grelina). Como dato interesante, la grelina también activa partes de tu cerebro implicadas en el aprendizaje. Esto significa que deberías considerar estudiar antes de comer, no inmediatamente después (Diano et al., 2006).
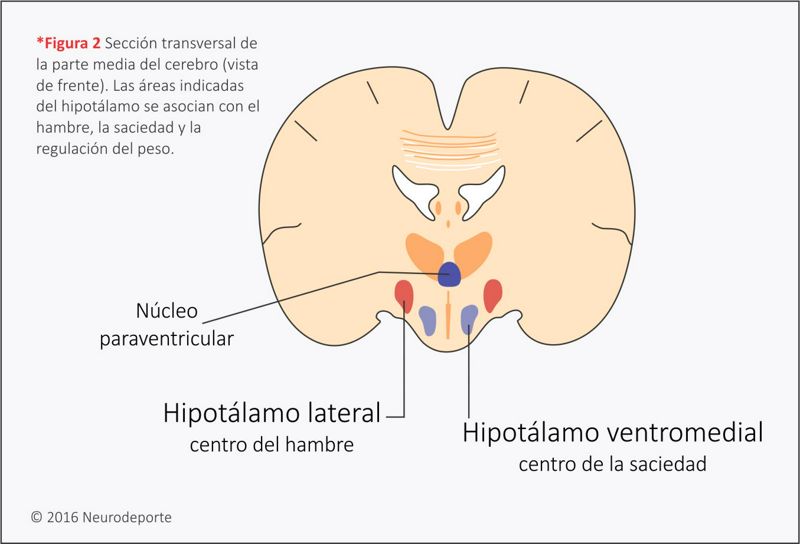
¿Cómo sabemos cuándo dejar de comer? Una segunda área del hipotálamo forma parte de un sistema de saciedad, o “mecanismo de alto” para comer. Si el hipotálamo ventromedial se destruyera, resultaría una sobrealimentación drástica. (Ventromedial se refiere al centro inferior del hipotálamo.) Ratas con ese daño comerán hasta inflarse y pesar 1000 gramos o más. Una rata normal pesa alrededor de 180 gramos. Para poner este aumento de peso en términos humanos, imagina que alguien que conoces y que pesa 80 kilogramos subiera a 455.
Una sustancia química llamada péptido 1 glucagonoide (glp-1) también participa en el efecto de dejar de comer. Tras ingerir un platillo, en los intestinos se libera glp-1, el cual viaja en el torrente sanguíneo hasta el cerebro. Al llegar allá suficiente glp- 1, tu deseo de comer se extingue (Hayes, De Jonghe y Kanoski, 2010). Como cabe imaginar, las píldoras de glp-1 son promisorias en el tratamiento de la obesidad (Raun et al., 2007). Por cierto, el hipotálamo tarda al menos 10 minutos en reaccionar desde que empiezas a comer. Por eso es poco probable que comas de más si comes despacio, lo que da tiempo a tu cerebro para recibir el mensaje de que ya estás satisfecho (Liu et al., 2000).
El núcleo paraventricular del hipotálamo también afecta al hambre (*figura 2). Esta área ayuda a mantener estables los niveles de azúcar en la sangre tanto iniciando como deteniendo el comer. El núcleo paraventricular es sensible a una sustancia llamada neuropéptido Y (npy). Si el npy está presente en grandes cantidades, un animal comerá hasta no poder contener otro bocado (Williams et al., 2004). Como dato interesante, casualmente el hipotálamo también responde a una sustancia química en la marihuana, la cual puede producir mucha hambre (el “monchis o la lenoa”) (Di- Marzo et al., 2001).
Además de saber cuándo empezar a comer y cuándo hay que poner fin a la alimentación, tu cerebro también controla tu peso en periodos largos. Hace esto monitoreando la cantidad de grasa acumulada en tu cuerpo en células adiposas especializadas (Ahima y Osei, 2004; Gloria-Bottini, Magrini y Bottini, 2009). Tu punto fijo es el peso que mantienes cuando no haces ningún esfuerzo por subir o bajar de peso. Cuando tu peso cae por debajo de su punto fijo, sentirás hambre casi todo el tiempo. Por otro lado. Las células grasas secretan una sustancia llamada leptina, que viaja en el torrente sanguíneo hasta el hipotálamo, donde nos dice que comamos menos (Williams et al., 2004).
Las sustancias mencionadas son solo algunas de las señales químicas que inician y detienen el comer (Geary, 2004; Turenius et al., 2009). Otras aún están por descubrirse. Con el tiempo, quizá harían posible controlar artificialmente el hambre. De ser así, podría haber mejores tratamientos para la obesidad extrema y el hecho de matarse de hambre (Batterham et al., 2003).
Esta primera aproximación al estudio de la obesidad y su relación con el cerebro puede presentar posibilidades de cuestionamiento e interés, en los próximos artículos iremos abordando más investigaciones sobre este tema tan importante que podría fortalecer los criterios para prescripción de la actividad física y/o ejercicio fìsico en la obesidad.
Referencias:
Organización Mundial de la Salud. (2011a). Obesidad y sobrepeso. Centro de prensa. En: http://www.who.int/mediacentre/factsheets/fs311/es... [26/11/11]
Chavarria Arciniega S. (2002). Definición y criterios de obesidad. Nutrición Clínica; 5(4): 236 – 240.
Ribeiro, A.C., LeSauter. J., Dupre, C., et al. (2009). Relationship of arousal to circadian anticipatory behavior: Ventromedial hypothalamus: One node in a hunger arousal network. European Journal of Neuroscience, 30(9), 1730-1738.
Woods, S.C., Schwartz, M.W, Baskin, D.G., et al. (2000). Food intake and the regulation of body weight. Annual Review of Psychology, 51, 255-277.
Freberg, L.A. (2010). Discovering biological psychology (2a. ed.). Belmont, CA: Cengage Learning/Wadsworth.
Castaneda, T. R., Tong, J., Datta, R. et al. (2010). Ghrelin in the regu1ation of body weight and metabolism. Frontiers in Neuroendocrinology, 31(1), 44-60.
Olszewski, P.K., Li, D., Grace, M.K., et al. (2003). Neural basis of orexigenic eff ects of ghrelin acting within lateral hypothalamus. Peptides, 24(4), 597-602.
Diano, S., Farr, S.A., Benoit, S. C. et al. (2006). Ghrelin controls hippocampal spine synapse density and memory performance. Nature Neuroscience, 9, 381-388.
Hayes, M. R., De Jonghe, B.C. y Kanoski, S. (2010). Role of the glucagon- like-peptide-1 receptor in the control of energy balance. Physiology & Behavior, 100(5), 503-510.
Raun, K., von Voss, P. y Knudsen, L.B. (2007). Liraglutide, a oncedaily human glucagon-like peptide-1 analog, minimizes food intake in severely obese minipigs. Obesity, 15(7), 1710-1716.
Liu, Y., Gao, J., Liu, H., et al. (2000). The temporal response of the brain aft er eating revealed by functional mri. Nature, 405, 1058-1062.
Williams, G., Cai, X.J., Elliott, J.C., et al. (2004). Anabolic neuropeptides. Physiology & Behavior. Special Reviews on Ingestive Science, 81(2), 211-222.
Di Marzo, V., Goparaju, S. K., Wang, L. et al. (2001). Leptin-regulated endocannabinoids are involved in maintaining food in take. Nature, 410(6830), 822-825.
Ahima, R. S. y Osei, S. Y. (2004). Leptin signaling. Physiology & Behavior, 81, 223-241.
Gloria-Bottini, F., Magrini, A. y Bottini, E. (2009). Th e effect of genetic and seasonal factors on birth weight. Early Human Development, 85(7), 439-441.
Geary, N. (2004). Endocrine controls of eating: CCK, leptin, and ghrelin. Physiology & Behavior, 81(5), 719-733.
Turenius, C. I., Htut, M.M., Prodon, D.A., et al. (2009). GABA(A) receptors in the lateral hypothalamus as mediators of satiety and body weight regulation. Brain Research, 1262, 16-24.
Batterham, R. L., Cohen, M. A., Elis, S. M. et al. (2003). Inhibition of food intake in obese subjects by peptide YY3-36. New England Journal of Medicine, 349(10), 941-948.
