Rol de la Termogénesis en la Pérdida de Grasa
Publicado 1 de febrero de 2017, 22:31
La termogénesis es un proceso que utiliza nuestro cuerpo para producir calor y de esta forma regular la temperatura del mismo. Estudios demuestran que el organismo utiliza varios mecanismos para producir este efecto, demostrándose que el tejido adiposo marrón (Brown Adipose Tissue, BAT), es uno de los principales órganos efectores (1). De manera general, el tejido adiposo es el órgano donde se almacena energía en forma de grasa (Triacilgliceroles), mientras que el BAT, en particular, debe su nombre al color que caracteriza la presencia de un gran número de mitocondrias, las cuales tienen una alta concentración de proteínas desacoplantes o termogeninas (cuyas siglas en ingles corresponden Uncoupling Protein, UCP) (Figura 1), además de una buena cantidad de receptores α y β adrenérgicos y una alta vascularización (2). El BAT se encuentra ubicado en zonas específicas del cuerpo como en la zona cervical del cuello, axilas, asociado a las costillas, alrededor del corazón y de los riñones presentando mayor distribución en fetos y neonatos en comparación con los adultos (3).
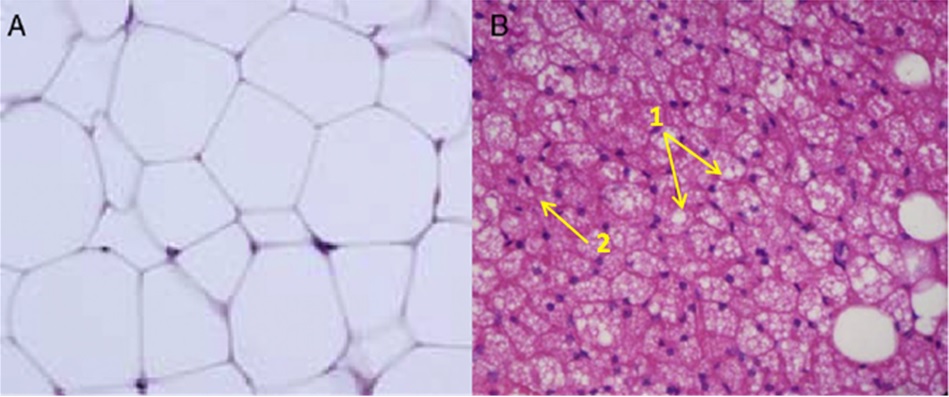
Figura 1. Corte histológico de Tejido adiposo. A) Tejido adiposo blanco (WAT), se observan una sola vacuola de lípidos y escasa cantidad de mitocondrias B) Tejido adiposo marrón (BAT), se observa: 1) múltiples vacuolas de grasa, 2) Zonas teñidas de color violeta oscuro que indican la presencia de un alto número de mitocondrias que presentan una alta cantidad de UCP1. Tomada de: Ráfols M (2013) (4).
Todo parece indicar que el BAT es el protagonista de la termogénesis en nuestro organismo, pero ¿a qué se debe este efecto? Como ya se mencionó anteriormente, el BAT tiene un gran número de UCPs, las cuales hacen parte de una familia de proteínas que se caracterizan por estar ubicadas en la membrana interna de las mitocondrias, inclusive en conjunto con los complejos que forman parte de la cadena respiratoria y fosforilación oxidativa. Existen varias isoformas de este grupo de proteínas, las cuales han sido denominadas como UCP1, UCP2, UCP3, UCP4 y UPC5, y aunque se ha podido determinar que todas conservan la misma estructura y función se ha demostrado que cada una de estas tiene su propio tejido en donde se expresan de manera específica (5).
Tal como su nombre lo indica, las UCPs son las encargadas de desacoplar la fosforilación oxidativa mediante el transporte de los protones (H+) desde el espacio intermembranal hacia la matriz mitocondrial, atravesando la membrana interna de la mitocondria, de tal forma que durante este proceso toda la energía química que se concentró, y que normalmente es destinada para la producción de ATP (durante el bombeo de protones a causa de la transferencia de electrones), se libera en forma de calor, lo cual trae como consecuencia un aumento de la temperatura y disminución de la producción de ATP (Figura 2). Varios estudios han demostrado que todo este proceso es responsable de producir una disminución en la eficiencia de la oxidación de sustratos como ácidos grasos, glucosa, entre otros, lo que finalmente provoca un aumento en el metabolismo basal en el tejido por la demanda de ATP (6,7).
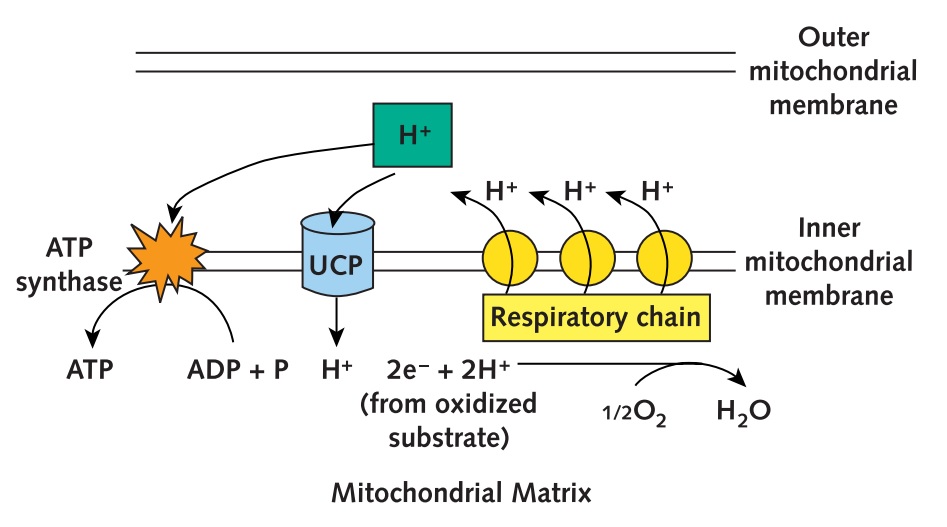 Figura 2. Mecanismo de acción de UCP1. Se observa el mecanismo de las UCPs para desacoplar la cadena respiratoria – fosforilación oxidativa, mostrando el transporte de protones (H+) desde el espacio intermembranal hasta la matriz mitocondrial disipando la energía en forma de calor y disminuyendo la producción de ATP. Tomada de: Palou 1998. Modificado: Marín E, 2016.
Figura 2. Mecanismo de acción de UCP1. Se observa el mecanismo de las UCPs para desacoplar la cadena respiratoria – fosforilación oxidativa, mostrando el transporte de protones (H+) desde el espacio intermembranal hasta la matriz mitocondrial disipando la energía en forma de calor y disminuyendo la producción de ATP. Tomada de: Palou 1998. Modificado: Marín E, 2016.
En el BAT se ubica principalmente la proteína desacoplante isoforma 1 (UCP1), que de igual forma se hace partícipe del mecanismo desacoplante mencionado anteriormente, lo que trae como consecuencia una alta actividad de lipólisis en este tejido, en donde las grasas almacenadas en forma de triacilgliceroles se degradan a glicerol y ácidos grasos, estos últimos son sustratos de la β-oxidación (vía de oxidación de ácidos grasos), siendo una vía que permite la degradación de grasas para aumentar la producción de ATP. De acuerdo a todo lo anterior, el BAT condiciona al tejido adiposo blanco (White Adipose Tissue, WAT) para que movilice las reservas de energía en forma de grasa (triacilgliceroles), con la finalidad de compensar la deficiencia en la producción de ATP, lo cual genera una disminución de la capacidad de almacenamiento de lípidos por parte del WAT, demostrándose de esta forma que quizás la termogénesis podría jugar un papel protagónico en la pérdida de grasa. En resumen, la deficiencia en la síntesis de energía (ATP) a consecuencia del desacoplamiento de la fosforilación oxidativa disminuye la capacidad de almacenamiento de lípidos por parte del WAT (8,9).
Diversos estudios han demostrado que el músculo esquelético puede actuar como un órgano endocrino, debido a que durante y luego del ejercicio físico el músculo tiene la capacidad de secretar unas sustancias denominadas mioquinas que tienen ciertos efectos sobre otros tejidos, como el tejido adiposo (10), durante la adaptación fisiológica al esfuerzo (Figura 3). Dentro de estas moléculas señalizantes podemos encontrar al coactivador 1α del receptor activado por el proliferador peroxisomal gamma (PGC1α), IL-6, factor neurotrófico derivado del cerebro (BDNF), irisina (fragmento de FNDC5 probablemente inducida por PGC1α), entre otras.
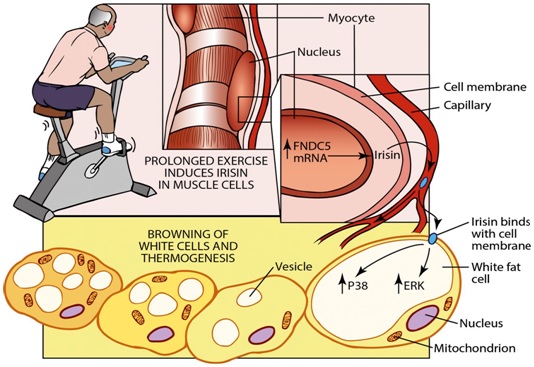 Figura 3. El musculo esquelético como órgano endocrino. La contracción muscular durante la actividad física promueve la secreción de mioquinas, compuestos capaces de producir efectos sobre el tejido adiposo blanco WAT. Tomado de: Wu J & Spiegelman BM (2014) (11).
Figura 3. El musculo esquelético como órgano endocrino. La contracción muscular durante la actividad física promueve la secreción de mioquinas, compuestos capaces de producir efectos sobre el tejido adiposo blanco WAT. Tomado de: Wu J & Spiegelman BM (2014) (11).
Estudios sobre el músculo esquelético en individuos obesos y con sedentarismo, demuestran que estos sujetos poseen menor cantidad de mitocondrias en comparación con individuos con un peso normal y con un estilo de vida activo, lo cual puede deberse a la falta de expresión de PGC1α (12), lo que hace pensar que dicha reducción de PGC1α está asociada a la obesidad y al estilo de vida sedentario. Ahora bien, la irisina, mioquina inducida vía AMPK/PGC1α/FDNC5, es de gran importancia en el fenómeno expuesto anteriormente puesto que ayuda a promover la termogénesis en el tejido adiposo subcutáneo mediante un aumento en la expresión del ARN mensajero para UCP1, conociéndose esto como el fenómeno de browning (Figura 4), el cual consiste en un aumento de mitocondrias con UCP1 en el WAT; por lo tanto, este tejido que normalmente almacena depósitos de grasa se transforma en un tejido adiposo marrón (BAT), con mayor actividad termogénica, lo que puede favorecer la pérdida de grasa en el organismo (13).
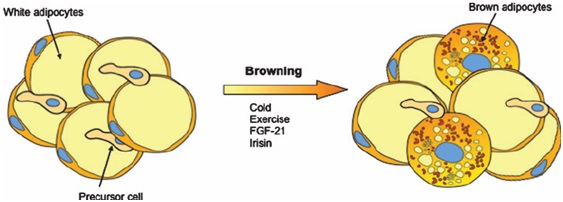
Figura 4. Fenómeno de Browning. Se observa la acción de la irisina, producida por el musculo esquelético, al aumentar la producción de mitocondrias y la expresión de UCP1, transformando al WAT en tejido adiposo beige, este último es más termogénico. Cabe resaltar que el fenómeno de Browning también se ha evidenciado luego de someter el organismo a bajas temperaturas (13), aunque esto será discutido en próximas entradas. Tomado de: Serra D, et al. (2013) (14).
En conclusión, la termogénesis juega un papel fundamental en la pérdida de grasa corporal debido a que durante este proceso existe un desacoplamiento de la fosforilación oxidativa, lo que disminuye la síntesis de ATP y como consecuencia hay un aumento en el metabolismo basal que propicia una reducción en la capacidad de almacenamiento de lípidos en el WAT, promoviéndose la pérdida de grasa en el organismo. De igual forma, el ejercicio físico no deja de ser unos de los factores que promueve este proceso a través de ciertas mioquinas (ej., PGC1α), que tienen la capacidad de producir efectos notables sobre el WAT, haciendo que este sea más termogénico; es decir, induce su transformación a tejido adiposo beige.
REFERENCIAS
1. Townsend KL & Tseng YH. Brown fat fuel utilization and thermogenesis. Trends Endocrinol Metab. 2014; 25: 168-177.
2. Cannon B, Nedergaard J. Brown adipose tissue: Function and physiological significance. Physiol Rev. 2004; 84: 277- 359.
3. Saito M. Brown adipose tissue as a regulator of energy expenditure and body fat in humans. Diabetes Metab J. 2013; 37: 22-29.
4. Ráfols ME. Tejido adiposo: heterogeneidad celular y diversidad funcional. Revista de Endocrinologia y Nutricion. 2014; 61(2): 100-112.
5. Fisler JS, Warden CH. Uncoupling proteins, dietary fat and the metabolic syndrome. Nutr Metab (Lond). 2006; 3: 38.
6. Azzu V, Brand MD. The on-off switches of the mitochondrial uncoupling proteins. Trends Biochem Sci. 2010; 35(5): 298- 307.
7. Souza BM, Assmann TS, Kliemann LM, Gross JL, Canani LH, Crispim D. The role of uncoupling protein 2 (UCP2) on the development of type 2 diabetes mellitus and its chronic complications. Arq Bras Endocrinol Metabol. 2011; 55(4): 239-248
8. Dalgaard LT, Pedersen O. Uncoupling proteins: functional characteristics and role in the pathogenesis of obesity and Type II diabetes. Diabetologia. 2001; 44(8): 946-965
9. Ricquier D. Respiration uncoupling and metabolism in the control of energy expenditure. Proc Nutr Soc. 2005; 64(1): 47-52.
10. Brandt C & Pedersen BK. The Role of Exercise-Induced Myokines in Muscle Homeostasis and the Defense against Chronic Diseases. J Biomed Biotechnol. 2010: 520258. doi:10.1155/2010/520258.
11. Wu J, Spiegelman BM. Irisin ERKs the Fat. Diabetes. 2014; 63(2): 381-383.
12. Eckardt K, Taube A, Eckel J. Obesity-associated insulin resistance in skeletal muscle: role of lipid accumulation and physical inactivity. Rev Endocr Metab Disord. 2011; 12(3): 163-172.
13. Vosselman M. Strategies to activate brown adipose tissue in humans. Thesis. 2015; School for Nutrition, Toxicology and Metabolism, Universitaire Pers Masstricht.
14. Serra D, Mera P, Malandrino MI, Mir JF, Herrero L. Mitochondrial Fatty Acid Oxidation in Obesity. Antioxidants & Redox Signaling. 2013; 19(3): 269-284.
