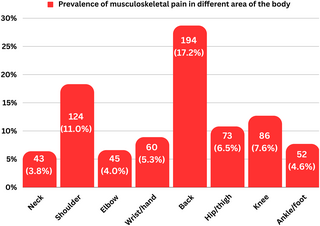
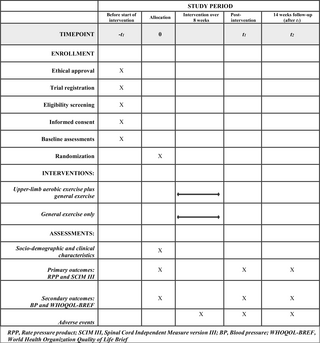
Resumen
La miocardiopatía diabética (MCD) es un factor importante en el desarrollo de la insuficiencia cardíaca. Las mitocondrias desempeñan un papel crucial en la regulación de la resistencia a la insulina, el estrés oxidativo y la inflamación, que afectan la progresión de la MCD. El ejercicio regular puede inducir una expresión alterada del ARN no codificante (ARNnc), que posteriormente afecta la expresión genética y la función de las proteínas. El mecanismo de la red de ARN no codificante relacionada con las mitocondrias inducida por el ejercicio en la regulación de la MCD sigue sin estar claro. Este estudio busca construir una innovadora red de ARNnc relacionada con las mitocondrias inducida por el ejercicio. El análisis bioinformático de los datos de secuenciación de ARN de un modelo de rata de ejercicio identificó 144 ARN no codificantes largos (ARNnc) expresados diferencialmente con criterios de corte de p< 0,05 y cambio de pliegue ≥1,0. GSE6880 y GSE4745 fueron los ARNm expresados diferencialmente del ventrículo izquierdo de la rata DCM que se descargaron de la base de datos GEO. Combinados con el ARNm expresado diferencialmente y el conjunto de datos MitoCarta 3.0, el gen mitocondrial Pdk4 se identificó como un gen objetivo. El análisis de predicción de miRNA utilizando miRanda y TargetScan confirmó que 5 miRNA tienen potencial para interactuar con los 144 lncRNA. La nueva red lncRNA-miRNA-Pdk4 se construyó por primera vez. Según la red de asociación de proteínas funcionales, la red ncRNA inducida por el ejercicio recientemente creada puede servir como un marcador de diagnóstico prometedor y un objetivo terapéutico, proporcionando una nueva perspectiva para comprender el mecanismo molecular de diferentes tipos de ejercicio para la prevención y el tratamiento de la miocardiopatía diabética.
Introducción
La miocardiopatía diabética (MCD) es una afección fisiopatológica derivada de la diabetes mellitus que puede provocar insuficiencia cardíaca (1). La Organización Mundial de la Salud (OMS) informa que aproximadamente 463 millones de personas en todo el mundo padecen diabetes, lo que constituye el 9,3% de la población mundial. En China, los pacientes con diabetes han aumentado del 0,7% en 1980 al 12,8% en 2017, lo que marca un aumento de 18 veces en cuarenta años (2). Además, más de un tercio de los adultos chinos tienen prediabetes y las tasas de concienciación, tratamiento y control son inadecuadas (3). La miocardiopatía diabética aumenta significativamente el riesgo de insuficiencia cardíaca, eventos cardiovasculares y mortalidad entre las personas con diabetes (1, 4). El diagnóstico preclínico eficaz es crucial para prevenir el desarrollo de la miocardiopatía diabética. La ecocardiografía sigue siendo la piedra angular para el diagnóstico de la miocardiopatía diabética (5). La resonancia magnética cardíaca ha ganado importancia como una modalidad no invasiva para evaluar la morfología, la función y la caracterización tisular cardíacas. También han surgido nuevos biomarcadores como posibles herramientas de diagnóstico. Estudios recientes se han centrado en evaluar los microARN circulantes y el ARN largo no codificante, las troponinas cardíacas y otros marcadores inflamatorios como indicadores de daño y disfunción cardíaca en la miocardiopatía diabética (6, 7). Es importante mencionar que el diagnóstico de la miocardiopatía diabética sigue siendo un desafío, requiriendo la exclusión de otras causas de miocardiopatía y una evaluación clínica cuidadosa.
El desarrollo de DCM está estrechamente asociado con la resistencia a la insulina, la inflamación y el estrés oxidativo, con una contribución significativa de las mitocondrias (8). Los niveles elevados de especies reactivas de oxígeno (ROS) provocan un aumento del estrés oxidativo y están relacionados con disfunciones en la contracción y relajación del miocardio y daño mitocondrial. Los niveles elevados de ROS pueden causar daño al ADN celular, las proteínas y los lípidos, lo que da lugar a daño y muerte celular irreversibles, lo que en última instancia conduce a una disfunción miocárdica. La principal causa del estrés oxidativo en la miocardiopatía dilatada es el aumento de la cantidad de ROS de las mitocondrias (9). La resistencia a la insulina disminuye la utilización de la glucosa y, cuando se combina con un metabolismo anormal de los ácidos grasos y niveles elevados de ROS, provoca daño a las proteínas mitocondriales y una fusión y fisión desreguladas, lo que resulta en una fisión mitocondrial amplificada y una disfunción mitocondrial eventual (10). En la diabetes tipo 2, la resistencia a la insulina daña la autofagia mitocondrial, lo que conduce a una menor eficacia en la limpieza de las mitocondrias dañadas y exacerba la apoptosis (11, 12). El tratamiento con niveles altos de glucosa de los cardiomiocitos da como resultado una expresión reducida del transportador de calcio mitocondrial (MCU) y una disminución posterior de los niveles de calcio libre de la matriz mitocondrial. Esto conduce a una menor actividad del complejo de piruvato deshidrogenasa, una menor oxidación-reducción de la glucosa, un aumento de la oxidación de los ácidos grasos, una disminución del potencial de membrana mitocondrial, un aumento del estrés oxidativo y, en última instancia, un aumento de la apoptosis de los cardiomiocitos (1). Estudios previos han demostrado una correlación entre la expresión aumentada de la piruvato deshidrogenasa quinasa 4 (PDK4) en ratas diabéticas y una función cardíaca reducida. Esta regulación positiva de la PDK4 conduce a una mayor oxidación de los ácidos grasos, lo que puede dar lugar a una disfunción mitocondrial y cardíaca (13, 14).
La actividad física regular puede tener un efecto positivo en la prevención y el control de la diabetes, ya que mejora el metabolismo de la glucosa y la insulina y reduce la probabilidad de sufrir enfermedades cardiovasculares. El ejercicio también puede mejorar la salud cardiovascular y pulmonar, lo que conduce a una menor incidencia y mortalidad de la miocardiopatía dilatada (MCD).15). El ejercicio agudo o crónico puede beneficiar tanto a la población sana como a la diabética. Esta intervención mejora funciones importantes como la acción de la insulina, el peso corporal, la tolerancia a la glucosa, la respuesta GLUT-4, la fosforilación de IRS1 y Akt, la respuesta inflamatoria, la biogénesis mitocondrial, la capacidad oxidativa, la actividad enzimática mitocondrial, el nivel de síntesis de ATP y otras (16, 17). Los ejercicios aeróbicos, ya sea solos o en combinación con entrenamiento de resistencia, ofrecen posibles beneficios antiateroscleróticos, un menor riesgo de enfermedad cardiovascular y niveles más bajos de triglicéridos en el hígado (18). El entrenamiento en intervalos de alta intensidad tiene el potencial de reducir los niveles de grasa hepática, fosfatasa alcalina y niveles de hemoglobina glicosilada (19). Por el contrario, el ejercicio aeróbico puede mejorar la sensibilidad a la insulina, mientras que el entrenamiento de resistencia puede aumentar la masa muscular y la expresión de GLUT4, mejorando así la ingesta de glucosa en sangre (20). Se ha demostrado que el entrenamiento físico induce cambios en las concentraciones de exerquina que median la diabetes tipo 2 y pueden ser relevantes para el control metabólico en pacientes con diabetes mellitus tipo 2 (21). El metaanálisis indicó que el entrenamiento físico podría inducir un aumento de adiponectina, FGF-21 e IL-10 y una disminución de fetuina-A, IL-6, leptina, resistina, TNF-a, visfatina y también HbA1c (21). El músculo esquelético, un importante órgano de secreción de mioquinas, desempeña un papel crucial en la mediación de la diabetes y la miocardiopatía diabética a través de diversas vías metabólicas mediante la comunicación entre músculos y órganos (22).
Se ha descubierto que el ARN no codificante (ARNnc) se expresa en exceso en personas con diabetes y desempeña un papel fundamental en la regulación del funcionamiento del páncreas, el hígado, el músculo esquelético y el tejido adiposo durante la aparición de la diabetes. Este descubrimiento destaca su potencial como biomarcador para el diagnóstico y el tratamiento de la diabetes (23, 24). El ARN largo no codificante (lncRNA) desempeña un papel crucial en la regulación del ciclo celular, la diferenciación celular, el metabolismo celular y varios cambios patológicos al influir en factores como la transcripción genética, la traducción y la estabilidad del ARN (25, 26). Además, el lncRNA regula la homeostasis de las proteínas mitocondriales, lo que afecta el control de la calidad mitocondrial y ayuda en el manejo de la diabetes y las complicaciones relacionadas (27). El ejercicio de intensidad moderada y alta puede prevenir la disfunción cardíaca y de las arterias coronarias inducida por la diabetes. Además, se ha identificado al miR-126 como un posible biomarcador de diagnóstico para detectar anomalías vasculares tempranas de las arterias coronarias y rastrear cambios dinámicos en la salud de las arterias coronarias debido al ejercicio (28).
Por lo tanto, este estudio tiene como objetivo investigar el mecanismo regulador de la red de lncRNA relacionada con las mitocondrias inducida por el ejercicio en la mejora de la miocardiopatía diabética. Además, tiene como objetivo identificar la interrelación entre los genes diferenciales inducidos por el ejercicio en el músculo esquelético y la regulación de la función cardíaca. Además, este estudio tiene como objetivo descubrir nuevos biomarcadores de lncRNA que puedan ofrecer nuevos conocimientos sobre el diagnóstico y el tratamiento de la miocardiopatía diabética.
Materiales y métodos
Animales y entrenamiento físico
Dieciocho ratas macho sanas SD (6 semanas de edad) fueron adquiridas a Beijing Vital River Laboratory Animal Technology Company. Las ratas fueron mantenidas en un ambiente estándar con libre acceso a comida y agua y sometidas a un ciclo de luz/oscuridad de 12 horas. La temperatura de su ambiente se mantuvo a 18-22°C con una humedad relativa del 50%-60%. El estudio fue aprobado por el Comité Ético de la Universidad del Deporte de Tianjin (20190311). Las ratas fueron divididas en tres grupos al azar (6 para cada grupo): el grupo de control (C), el grupo de ejercicio aeróbico a largo plazo (OE) y el grupo de ejercicio exhaustivo agudo (AE). El grupo OE realizó ejercicio aeróbico en una cinta de correr inclinada a 0° durante 60 minutos por día, cinco días a la semana, a una velocidad de 20 m/min durante ocho semanas. En el grupo AE, las ratas se sometieron a una única sesión de ejercicio exhaustivo agudo después de ocho semanas de alimentación normal. Las ratas corrieron en una cinta a una velocidad de 10 m/min y una pendiente de 0°, soportando un aumento progresivo de la carga. La velocidad aumentó 5 m/min cada 5 minutos hasta el agotamiento. Las ratas de control permanecieron inactivas. Las ratas fueron anestesiadas con isoflurano y se les hizo sangrar hasta morir por el corazón, tras lo cual se les extrajo el músculo gastrocnemio.
Extracción de ARN y análisis de secuenciación
Se seleccionaron tres muestras al azar y se extrajo el ARN total de las muestras de músculo gastrocnemio utilizando un kit de aislamiento de ARN (Vazyme, Nanjing, China) de acuerdo con el protocolo del fabricante. Las lecturas sin procesar se generaron mediante secuenciación de alto rendimiento y se muestran en el formato FASTQ. Para obtener lecturas de alta calidad para el análisis posterior, las lecturas sin procesar se sometieron a un filtro de calidad. Trimmomatic (29) se utilizó para filtrar las bases de baja calidad y las N-bases o lecturas de baja calidad. HISAT2 (30) se utilizó para alinear lecturas limpias con el genoma de referencia de la especie experimental, la muestra se evaluó mediante alineamiento genómico y genético. Y Stringtie (31) se utilizó para ensamblar y fusionar las transcripciones. Se combinaron cuatro enfoques computacionales, CPC2/CNCI/Pfam/CPAT, para clasificar los candidatos de ARN no codificante de proteínas. Se utilizó StringTie para calcular los FPKM de lncRNA y de genes codificantes en cada muestra. Los FPKM de los genes se calcularon sumando los FPKM de las transcripciones en cada grupo de genes. Las transcripciones diferenciales con pag-valores < 0,05 y un cambio de pliegue ≥1 se establecieron como el umbral para la expresión significativamente diferencial de los genes expresados diferencialmente (GED). Los paquetes topGO R y KOBAS (32) se utilizó el software para realizar el enriquecimiento de Gene Ontology (GO) y el análisis de enriquecimiento de la vía de la Enciclopedia de Kyoto de Genes y Genomas (KEGG). Miranda (http://mirtoolsgallery.tech/mirtoolsgallery/) y TargetScan (https://www.targetscan.org) se utilizaron para predecir los miRNA que interactúan con ARNm y lncRNA expresados de forma diferente. Los miRNA predichos en ambos programas se filtraron para el análisis predictivo. La interacción génica y el análisis de enriquecimiento se llevaron a cabo con la ayuda de STRING (https://string-db.org/).
Identificación de genes expresados diferencialmente a partir de la base de datos GEO
«Miocardiopatía diabética» se utilizó como término de búsqueda en la base de datos GEO (https://www.ncbi.nlm.nih.gov/geo/), y se adquirieron dos conjuntos de datos genéticos, GSE6880 y GSE4745, de la base de datos. El conjunto de datos GSE6880 incluye resultados de microarrays de seis muestras de miocardio ventricular izquierdo de ratas (tres en el grupo de control y tres en el grupo de diabetes). GSE4745 contenía resultados de microarrays de 24 muestras de miocardio ventricular izquierdo de ratas. Ocho muestras de los grupos de control y diabetes…