Resumen
Fondo
Los retrovirus endógenos humanos (HERV) son virus fósiles que componen el 8 % del genoma humano y desempeñan varias funciones importantes en la fisiología humana, incluida la reparación muscular/miogénesis. Se cree que la inflamación también puede regular la expresión de HERV y, por lo tanto, puede contribuir a la reparación muscular, especialmente después del ejercicio físico. Por lo tanto, este estudio tuvo como objetivo evaluar el nivel de expresión de HERV y el perfil de inflamación en los ejercicios de resistencia de los practicantes después de una sesión de entrenamiento de fuerza aguda.
Métodos
Los voluntarios sanos se dividieron en dos grupos: practicantes habituales de ejercicios de resistencia (GRE, n = 27) e individuos no entrenados (Grupo de control, n = 20). Todos los individuos realizaron una sección de ejercicios de fuerza. Se recogieron muestras de sangre antes del ejercicio (T0) y 45 minutos después de la sesión de entrenamiento (T1). Se cuantificaron de forma relativa HERV-K (HML1-10) y W, se evaluaron la concentración de citocinas y las micropartículas circulantes.
Resultados
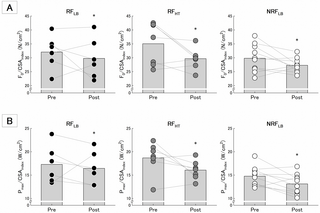
REG presentó un mayor nivel de expresión de HERV-W (~2,5 veces de cambio) que CG en T1 (p<0,01). No se observaron diferencias en los niveles de expresión de HERV-K entre los grupos, así como en los puntos temporales. Se verificaron niveles séricos más altos de TNF-α e IL-10 después de la sesión de entrenamiento en REG y CG (p<0,01), y en REG se encontró una correlación positiva entre los niveles de TNF-α en T1 e IL-10 en T0 (p = 0,01). Finalmente, se observó un menor porcentaje de micropartículas endoteliales en REG en T1 que en T0 (p = 0,04).
Conclusión
Los individuos REG mostraron una regulación positiva significativa de HERV-W y una modulación de los marcadores inflamatorios en comparación con los CG. Este efecto combinado podría potencialmente apoyar el proceso de reparación del músculo esquelético en los individuos que hacen ejercicio.
Introducción
La inflamación es un proceso biológico vital y ubicuo que implica la activación de células inmunes y no inmunes con el objetivo de no sólo garantizar la defensa del huésped contra agentes patógenos y toxinas, sino también restablecer la homeostasis tisular en respuesta a una lesión celular/tisular. En particular, la inflamación aguda se caracteriza por eventos y moléculas liberadoras bien coordinadas y autocontroladas que se mantienen mientras la amenaza/lesión no haya sido totalmente eliminada/resuelta, desapareciendo después de que estos eventos hayan pasado (1, 2). Curiosamente, se reconoce que una sesión de entrenamiento físico puede desencadenar una respuesta inflamatoria aguda en la que su extensión depende tanto de la intensidad como de la duración (3). En este sentido, la magnitud de la inflamación provocada de forma aguda por el entrenamiento físico se puede evaluar a través de los niveles y la expresión de diferentes biomarcadores inflamatorios (4).
Entre algunos biomarcadores, la IL-6 es la molécula más estudiada liberada por el músculo esquelético en contracción durante la realización de ejercicio físico y presenta un amplio rango de acciones, que incluyen su capacidad para: (1) promover la lipólisis en el tejido adiposo y la glucólisis en el hígado; (2) mejorar la captación de glucosa por el músculo durante la sesión de ejercicio; (3) estimular la multiplicación de células satélite e impulsar la hipertrofia del músculo; (4) inducir el aumento de los niveles sistémicos de la citocina antiinflamatoria IL-10, conduciendo a un control de la inflamación generada por la realización de ejercicio físico, entre otras acciones.3).
Otra citocina que aumenta rápidamente en el torrente sanguíneo en respuesta al daño muscular relacionado con el entrenamiento físico es el factor de necrosis tumoral alfa (TNF-α). Este factor puede ser liberado por diferentes tipos de células, especialmente monocitos circulantes, siendo contribuyentes particularmente notables (5). En cuanto a la literatura, esta citocina presenta varias acciones reguladoras en la inflamación y la lesión tisular, y, aunque puede estar involucrada en la inducción tanto de la necrosis como de la apoptosis de los miocitos, y, particularmente, en situaciones inflamatorias crónicas (6) el TNF-α es capaz de regular la miogénesis y la regeneración muscular (7, 8).
Más allá de estos aspectos, se postula que el estado de inflamación parece impactar en la transcripción de los Retrovirus Endógenos Humanos (HERVs). Estos se han fijado dentro del genoma de sus células germinales, y durante el proceso de endogenización los HERVs fueron transmitidos por retrotransposición, infección horizontal y vertical y posteriormente por herencia mendeliana (9–12). Hoy se sabe que el 8% del genoma humano está compuesto por secuencias de HERVs. Los HERVs fueron expuestos a varios eventos de mutación, y como resultado, existen pocas secuencias genómicas completas del genoma retroviral clásico, ya que la mayoría de sus genes están aislados y distribuidos dentro del genoma, o incluso muchos de ellos están silenciados por codones de parada dentro de los genes virales, lo que lleva a que no se produzca la replicación activa de los HERVs.13), aunque la proteína HERV todavía se expresa y se puede formar el virión (14–17).
Los HERVs desempeñan un papel fundamental en diferentes situaciones fisiológicas. En este sentido, uno de los genes env restantes y casi completos de HERV-W es el responsable de la expresión de la sincitina-1, que es una proteína crítica en el proceso de formación del sinciciotrofoblasto y la miogénesis (18–20) De hecho, también se ha evaluado el papel fusogénico de los HERV en la miogénesis humana, y se ha descrito que HERV-W presenta un papel clave en la fusión celular de los miotubos en atletas que realizan ejercicio de larga duración, como el ciclismo de competición (21). Además, la expresión de HERV en estos atletas parece ser diversa, HERV-K también estaba regulado positivamente en ellos, lo que apunta al hecho de que el ejercicio físico también puede modular la expresión de otros HERV.
Respecto a la interacción entre la inflamación y la transcripción de HERV, se sugirió que la inflamación podría conducir a cambios complejos y necesarios para promover la expresión de HERV (22). Para aclarar este escenario, informes previos han descrito que el aumento de la expresión de HERV en respuesta a citocinas proinflamatorias depende de la inducción del aumento del factor de transcripción para unirse y activar el LTR de HERV (23), provocando directamente el aumento de las proteínas pol, gag y env de HERV (24). Aunque la interacción entre la inflamación y la expresión de HERV se discute más durante las situaciones de inflamación crónica (25) Esta interacción en el contexto de la inflamación aguda no se comprende completamente, y puede incluir la respuesta a una sesión de entrenamiento de ejercicio de resistencia (fuerza).
Más allá de estas moléculas, la inflamación aguda promovida por el ejercicio físico también puede provocar la liberación de micropartículas, que son vesículas que se originan tras estímulos como activación o apoptosis de diferentes tipos celulares (células endoteliales, plaquetas, monocitos, entre otras), presentando así funciones distintas, no sólo en el contexto del entrenamiento físico sino también en enfermedades como la hipertensión (26), hipercolesterolemia (27), esclerosis sistémica (28) entre otros (29).
A partir de estos datos, queda claro que el ejercicio físico agudo es capaz de regular y promover patrones distintos de expresión genética, que incluyen vías relacionadas con la inflamación (29) y reparación muscular (30) así como también podría modificar los niveles circulantes de citocinas (3) y micropartículas (29). Sin embargo, hasta ahora, el efecto agudo de una única sesión de ejercicio de fuerza realizada por individuos sanos en los niveles sistémicos de citocinas y micropartículas aún es poco comprendido y a veces contradictorio, así como también no hay datos sobre la dinámica de la expresión de HERV en este contexto. Por lo tanto, en el presente estudio, nuestro objetivo fue evaluar el nivel de concentración de citocinas pro y antiinflamatorias de HERV-W-env, HERV-K (HML1-10) y caracterizar las micropartículas circulantes en practicantes y no practicantes de ejercicios de resistencia después de una sesión aguda de entrenamiento de fuerza.
Materiales y métodos
Diseño y población del estudio
Se reclutaron y entrevistaron adultos sanos (n = 47) de ambos sexos para recolectar información relacionada con su rutina habitual de práctica de entrenamiento de fuerza. Los voluntarios fueron orientados a realizar dos visitas independientes al laboratorio en días diferentes. Durante la primera visita, los participantes respondieron a un cuestionario previo a la participación que incluía información demográfica más detalles sobre su rutina de práctica de ejercicio de fuerza. De acuerdo con los datos obtenidos en este cuestionario, los voluntarios se separaron en dos grupos: practicantes regulares de entrenamiento de fuerza (REG, n = 27) y no practicantes de entrenamiento de fuerza (grupo control, GC, n = 20). En la segunda visita, entre las 8 y las 10 am, se recogió una muestra de sangre en ayunas antes de la sesión de entrenamiento (T0). Poco después, se proporcionó una comida estandarizada para asegurar que todos los participantes tuvieran la misma cantidad de calorías antes de la sesión de ejercicio de fuerza. Después de 30 minutos, los voluntarios realizaron la sesión de ejercicio y 45 minutos después de completar esta sesión, se recogió la segunda muestra de sangre (T1). Los sujetos recibieron instrucciones no solo de mantener su patrón alimentario, sino también de abstenerse de beber alcohol y hacer ejercicio durante 48 horas, así como de tomar cafeína durante las 24 horas previas a la segunda visita. Este estudio se realizó en la misma academia de gimnasia y laboratorio de investigación, ambos pertenecientes a la Universidade Santo Amaro (UNISA), São Paulo, Brasil, y todos los voluntarios eran estudiantes, profesores y empleados de la universidad. Se excluyeron del estudio las personas que presentaban antecedentes de enfermedades autoinmunes, incluidas las familiares, o cualquier afección inflamatoria (como diabetes, obesidad, neoplasia u otras enfermedades inflamatorias). El muestreo se realizó de 1El marzo 2021 al 1El agosto 2021.
Ética
Los voluntarios fueron informados individualmente sobre los riesgos y beneficios propuestos del estudio, y aquellos que aceptaron participar fueron orientados a leer y firmar el formulario de consentimiento escrito previamente aprobado por el Comité de Ética e Investigación de la Universidad Santo Amaro (UNISA, protocolo # 4.237.943). Vale la pena mencionar que el estudio se realizó de acuerdo con la Declaración de Helsinki, y también con las Normas Éticas presentadas en 2016 por Harris (31).
Protocolo de entrenamiento físico
El protocolo de la sesión de ejercicios de fuerza consistió en (i) un calentamiento general en una cinta de correr (E720; Movement®, Pompeia, SP, Brasil) caminando a 5 km/h durante cinco minutos seguido de 3 minutos de estiramiento ligero de los miembros inferiores y superiores; (ii) seguido de la realización de ejercicios de fuerza en tres series de 8-10 repeticiones máximas, incluyendo diez tipos diferentes (prensa de piernas, tirón alto, extensión de rodillas, flexión de codo, flexión de rodilla, puller de tríceps, press de banca, abducción de piernas, tirón bajo, aducción de piernas). Es importante citar que en la ocurrencia de más o menos repeticiones (>2) excediendo el rango objetivo de 8-10 repeticiones en una serie, se aplicó corrección de peso (1-2%). El intervalo de recuperación entre series fue de 60 segundos. Los sujetos fueron orientados a realizar una cadencia de repeticiones con una acción concéntrica de aproximadamente 1 segundo y una acción excéntrica de aproximadamente 2 segundos.
Preparación de muestras
Como se mencionó anteriormente, la primera recolección de muestra de sangre se realizó en ayunas y antes de la sesión de ejercicio, mientras que la segunda recolección de muestra de sangre se realizó 45 minutos después de finalizada la sesión de ejercicio. Todas las muestras de sangre se recogieron en tubos que contenían o no EDTA anticoagulante para obtener suero o plasma, así como células mononucleares de sangre periférica (PBMC). Las PBMC se utilizaron para evaluar la expresión de HERV, mientras que las micropartículas circulantes se analizaron en el plasma y las muestras de suero se utilizaron para el análisis de citocinas.
Análisis molecular
El protocolo para la preparación de muestras para el análisis molecular se llevó a cabo como se describió anteriormente (32–34). Brevemente, se extrajo el ARN total de las PBMC utilizando el método Trizol (Invitrogen). Se realizó una descontaminación rigurosa del ADN genómico con DNA free turbo (Ambion). La ausencia de ADN genómico contaminante se confirmó mediante PCR en tiempo real con cebadores…