Resumen
Objetivos
La pérdida de peso corporal se observa a menudo en el cáncer de páncreas y también predice un mal pronóstico. Por tanto, mantener la masa muscular es un objetivo esencial del tratamiento. El objetivo principal fue investigar si el entrenamiento de resistencia progresiva afecta los compartimentos musculares y del tejido adiposo. Además, se investigó el efecto de la composición corporal sobre la supervivencia general (SG).
Métodos
En el estudio aleatorizado SUPPORT, 65 pacientes fueron asignados a un entrenamiento de resistencia de 6 meses (2 veces por semana) o a un grupo de control con atención habitual. Como criterio de valoración secundario, se evaluó la fuerza muscular de las extremidades superiores e inferiores antes y después del período de intervención. Las tomografías computarizadas de rutina se evaluaron en el nivel lumbar L3/4 para cuantificar el área de grasa total, el área de grasa visceral, el área de grasa subcutánea, el área de grasa intramuscular, la proporción de grasa visceral a subcutánea (VFR), el músculo -área (MA), densidad muscular e índice músculo-esquelético (SMI). Se recuperaron los datos del sistema operativo.
Resultados
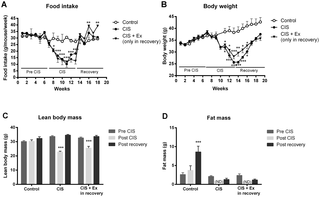
De 65 pacientes, 53 tenían tomografías computarizadas adecuadas al inicio del estudio y 28 completaron el período de intervención con tomografías computarizadas adecuadas. No se observaron efectos significativos del entrenamiento de resistencia en la composición corporal (p>0,05; tamaños del efecto ω2pag <0,02). Se encontraron correlaciones significativas de moderadas a altas entre la MA y los parámetros de fuerza muscular (r = 0,57–0,85; p<0,001). Un VFR alto al inicio del estudio fue un predictor de una SG deficiente (VFR≥1,3 frente a <1,3; mediana de SG 14,6 frente a 45,3 meses; p = 0,012). La pérdida de masa muscular también fue un predictor de una SG deficiente (pérdida versus ganancia de SMI; mediana de SG 24,6 versus 50,8 meses; p = 0,049).
Conclusión
Existe potencial anabólico en pacientes con cáncer de páncreas resecable. Un entrenamiento de resistencia progresiva puede ayudar a los pacientes a mantener su masa muscular y evitar el agotamiento muscular. La masa muscular cuantificada por TC a nivel de L3/4 mostró una buena correlación con la fuerza muscular. Por lo tanto, mantener la masa muscular y la fuerza muscular mediante un entrenamiento de resistencia estructurado podría ayudar a los pacientes a mantener su funcionamiento físico. Un VFR alto al inicio del estudio y una gran pérdida de masa muscular son predictores de una SG deficiente. Registrado en ClinicalTrials.gov (NCT01977066).
Introducción
En muchos pacientes con cáncer, la pérdida de peso suele estar presente en el momento del diagnóstico.1). Los pacientes con cáncer de páncreas en particular suelen sufrir una pérdida grave de peso y de masa muscular (2).
El cáncer de páncreas es una enfermedad altamente maligna frecuente con un pronóstico muy malo y una mortalidad alta consecutiva con una tasa de supervivencia a 5 años en todas las etapas del 6% (3). La mayoría de los cánceres de páncreas se diagnostican en una etapa tardía debido a síntomas muy tardíos e inespecíficos (4). En hasta el 74% de los pacientes con cáncer de páncreas, la caquexia, un síndrome de emaciación multifactorial caracterizado por una pérdida continua de masa muscular con o sin pérdida de masa grasa, inflamación sistémica y generalmente pérdida de peso.5) está presente (6). Además, la pérdida de masa muscular y de peso conduce a una reducción de la fuerza muscular, lo que además empeora la capacidad funcional. Además de las deficiencias funcionales, los pacientes con caquexia tienden a tener más fatiga y un mal pronóstico (5, 7, 8). La pérdida de masa muscular (MA) y la composición corporal con una alta proporción de tejido adiposo visceral a tejido adiposo subcutáneo (VFR) se informaron como predictores de mal pronóstico en pacientes con cáncer de pulmón (9). Por tanto, mantener la MA, el funcionamiento físico y la calidad de vida se encuentran entre los principales objetivos del tratamiento en pacientes con cáncer de páncreas.
Se sabe que el ejercicio tiene efectos positivos sobre la enfermedad y los efectos secundarios relacionados con el tratamiento en pacientes con cáncer durante y después del tratamiento del cáncer, como mejoras en la condición física (10), calidad de vida (11) y fatiga (12). Se ha informado que el entrenamiento de resistencia en particular tiene un efecto positivo en la mejora de la MA debido al aumento de la síntesis de proteínas musculares y a la mejora del metabolismo muscular (13). Recientemente, nuestro grupo demostró que los pacientes con cáncer de páncreas pueden beneficiarse del entrenamiento de resistencia progresivo con respecto a la fuerza muscular y la calidad de vida como parte del estudio SUPPORT (14, 15). La primera evidencia también sugiere que el ejercicio juega un papel importante en la recurrencia y supervivencia del cáncer (16).
Aquí presentamos un análisis exploratorio de los compartimentos del tejido muscular y adiposo mediante tomografías computarizadas para investigar los efectos del entrenamiento de resistencia en los compartimentos del tejido muscular y adiposo en el estudio SUPPORT, controlado, aleatorio y mencionado anteriormente.
El objetivo principal fue investigar si el grupo de intervención mostró un mejor curso de composición corporal con mayores compartimentos de tejido muscular que el grupo de control. El objetivo secundario fue identificar factores predictivos en la composición corporal que influyen en la supervivencia de pacientes con cáncer de páncreas.
Materiales y métodos
Población de estudio
Los datos del estudio SUPPORT (Entrenamiento de resistencia progresivo supervisado para pacientes con cáncer de páncreas), un ensayo de intervención controlado aleatorio que investiga los efectos de un entrenamiento de resistencia progresivo de 6 meses de duración en pacientes con cáncer de páncreas, se utilizaron de manera post hoc para el presente análisis para investigar los efectos de la intervención de entrenamiento en los compartimentos del tejido muscular y adiposo. El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Heidelberg (S-409/2013) y ha sido registrado en ClinicalTrials.gov (NCT01977066). Los métodos, el diseño del estudio y los principales resultados del estudio SUPPORT con respecto a los resultados primarios y secundarios preespecificados se han publicado en detalle recientemente (14, 15, 17).
En resumen, desde 12/2013 hasta 12/2015, se reclutaron 65 de 304 pacientes elegibles con los siguientes criterios de inclusión: edad ≥18 años, cáncer resecable o no resecable (estadio I-IV), tratamiento en el Hospital Universitario de Heidelberg en Alemania, conocimientos suficientes del idioma alemán y consentimiento informado. Los pacientes con adenocarcinoma del conducto biliar distal y con adenocarcinoma ductal ampular también fueron elegibles debido al mismo régimen de tratamiento médico. Los siguientes criterios de elegibilidad se cambiaron muy temprano en el reclutamiento para mejorar la baja tasa de reclutamiento: también se incluyeron pacientes que realizaron deportes más de 150 minutos por semana, estadio III y IV y pacientes que tuvieron su resección quirúrgica en los últimos 12 meses. Los criterios de exclusión fueron: insuficiencia cardíaca superior al grado III de la New York Heart Association (NYHA) o arritmia incierta, hipertensión no controlada, disfunción renal grave (TFG <30%, creatinina >3 mg/dl), cicatrización incompleta de heridas, capacidad hematológica insuficiente. (ya sea valor de hemoglobina <8 g/dl o trombocitos <50.000), capacidad reducida para pararse o caminar, o cualquier otra comorbilidad que impidiera su participación.
Los pacientes que vivían cerca del centro de estudio (<20 km) fueron asignados aleatoriamente a un grupo de entrenamiento de resistencia progresivo supervisado (RT1) o al grupo de control (CON). Los pacientes que vivían más lejos fueron asignados aleatoriamente a un grupo de entrenamiento de resistencia progresiva (RT2) en el hogar o a CON. Se utilizó una aleatorización en bloques 2:1, estratificada por sexo y edad, con un generador de números aleatorios y tamaños de bloques variables de 3 y 6. La aleatorización de un paciente fue realizada por un biometrista independiente de acuerdo con la lista de asignación preespecificada. La evaluación de los parámetros de resultado se llevó a cabo antes del inicio de la intervención (T0, valor inicial) y después de la intervención después de 6 meses (T2). Las evaluaciones iniciales se realizaron como mínimo 3 meses después de la resección quirúrgica para permitir una cicatrización adecuada de la herida. Por razones de viabilidad y seguridad, se reveló el cegamiento de partes del personal del estudio.
Intervención
RT1 y RT2 realizaron un programa de entrenamiento de resistencia durante un período de 6 meses con sesiones de entrenamiento de aproximadamente 60 minutos dos veces por semana. Las sesiones incluyeron ejercicios de resistencia para los principales grupos musculares de las extremidades superiores e inferiores con pesos crecientes adaptados al rendimiento. Después de una fase de adaptación de cuatro semanas, los pacientes realizaron 8 ejercicios/sesión con 2-3 series con 8-12 repeticiones. El entrenamiento de los pacientes en RT1 se llevó a cabo en un centro de ejercicios en el campus de la Universidad de Heidelberg en máquinas de pesas bajo la supervisión de un fisioterapeuta especializado con intensidades de ejercicio del 60 al 80 % como máximo en una repetición. Los pacientes en RT2 se ejercitaron con un manual de entrenamiento por su cuenta en casa con intensidades de ejercicio de 14 a 16 en la Escala de Borg de Esfuerzo Percibido (18) con el apoyo del fisioterapeuta mediante llamadas telefónicas semanales. Cada sesión de formación realizada quedó documentada en una ficha de formación.
CON recibió la atención habitual acorde con su tratamiento contra el cáncer. Se llamó a los pacientes una vez al mes y se les preguntó sobre los posibles efectos secundarios relacionados con el tratamiento y se les aconsejó que no cambiaran su conducta de ejercicio.
Evaluación de resultados
Para este análisis se analizaron tomografías computarizadas en T0 y T2. Todas las tomografías computarizadas se realizaron en la rutina clínica con indicación clínica sin que se realizaran tomografías computarizadas adicionales en el contexto del estudio SUPPORT. Los criterios de inclusión para los pacientes del estudio SUPPORT en este análisis post-hoc fueron: tomografías computarizadas adecuadas en calidad y tiempo para T0 y T2 (fecha de la tomografía computarizada inicial -120 días antes y +35 días después de T0; fecha para el siguiente CT de revisión en T2–35 días antes y +35 días después de T2), tomografías computarizadas técnicamente evaluables, nivel entre los cuerpos vertebrales lumbares 3 y 4 (L3/4) incluidos en las exploraciones, paciente en el campo de vista.
Cuantificación de compartimentos corporales mediante tomografía computarizada.
Se obtuvieron tomografías computarizadas con contraste del PACS institucional (GE Medical Systems, Buckinghamshire, Reino Unido) y se realizó una cuantificación basada en áreas con una herramienta de volumen semiautomática (Syngo Volume Tool, Siemens Healthineers, Munich, Berlín, Alemania). La cuantificación de los compartimentos corporales se realizó en un solo corte entre los cuerpos vertebrales lumbares 3 y 4 (L3/4) en la placa terminal inferior de L3 definiendo manualmente regiones específicas de interés (ROI) (9, 19, 20). Estos ROI se midieron utilizando valores umbral (en unidades Hounsfield; HU) y los volúmenes obtenidos (cm3) se dividieron por el grosor de la rebanada (cm) para obtener valores de área (cm2). De un total de 81 tomografías computarizadas, el 90% (n = 73) tenía un espesor de corte de 0,3 cm (5 con 0,5 cm; 2 con 0,2 cm y 1 con 0,4 cm).
El tejido adiposo se dividió en área de grasa total (TFA), área de grasa visceral (VFA) y área de grasa subcutánea (SFA). El TFA se midió dibujando el ROI alrededor de toda la circunferencia del cuerpo. El VFA se midió dibujando la ROI a lo largo del interior de la pared abdominal. La medición del tejido adiposo se restringió a un umbral superior de -30 HU y un umbral inferior de -190 HU (9, 20).
El tejido muscular se cuantificó en el mismo corte dibujando un ROI que incluye todos los músculos en ese nivel (M. erector spinae, M. psoas major, M. rectus abdominis, M. obliquus internus abdominis, M. obliquus externus abdominis, M. transversus abdominal, M. quadratus lumborum, M. latissimus dorsi). La primera medición del área muscular (MA150) se realizó con un amplio rango de un umbral superior de +150HU y un umbral inferior de -29HU (21, 22), que contiene también la infiltración grasa del tejido muscular. La segunda medición del área muscular (MA100) en el mismo ROI fue con un rango más pequeño de un umbral superior de +100HU y un umbral inferior de +40HU, excluyendo así la fracción de músculo infiltrado graso. Se obtuvo la densidad muscular media de las cuantificaciones musculares en HU (MD150 y médico100). En tercer lugar, el tejido adiposo dentro del ROI del músculo (IMFA, área de grasa intramuscular) se cuantificó con un umbral superior de -30 HU y un umbral inferior de -190 HU.
El SFA se calculó restando el VFA y el IMFA del TFA. La relación grasa visceral/subcutánea (VFR) se calculó dividiendo VFA/SFA (9). El índice de músculo esquelético (SMI) se calculó ajustando MA150 con altura del cuerpo (MA150/altura-cuerpo2; Unidad cm2/metro2) (21). Las diferencias de parámetros se calcularon mediante: parámetrodiferencia = parámetroT2 -parámetroT0.