Resumen
Objetivo
Una razón importante para la pérdida de movilidad en las personas mayores es la pérdida gradual de la masa corporal magra conocida como sarcopenia. La sarcopenia se asocia con una menor calidad de vida y mayores costos de atención médica. El beneficio de las estrategias que incluyen la intervención nutricional, el momento de la intervención y el ejercicio físico para mejorar la pérdida muscular, ya que el hallazgo de los estudios que investiga este problema ha sido inconsistente. Hemos realizado una revisión sistemática y un metanálisis para evaluar la capacidad de la suplementación con proteínas o aminoácidos para aumentar la masa corporal magra o la fuerza de los músculos de las piernas en pacientes de edad avanzada.
Métodos
Nueve estudios cumplieron con los criterios de inclusión de ser un estudio comparativo prospectivo o un ensayo controlado aleatorizado (ECA) que comparó la eficacia de una intervención de aminoácidos o suplementos de proteínas con la de un placebo en personas mayores (≥65 años) para la mejora de la masa corporal delgada (LBM), la fuerza muscular de las piernas o la reducción de la sarcopenia.
Resultados
La diferencia general en el cambio medio desde el inicio hasta el final del estudio en LBM entre los grupos de tratamiento y placebo fue de 0.34 kg, lo que no fue significativo (p = 0.386). Las diferencias generales en el cambio medio desde la línea de base en la prensa de doble pierna y la extensión de la pierna fueron 2.14 kg (p = 0.748) y 2.28 kg (p = 0.265), respectivamente, entre el grupo de tratamiento y el grupo placebo.
Introducción
La sarcopenia es una pérdida relacionada con la edad de masa muscular y fuerza, y se asocia con una menor calidad de vida resultante de una capacidad reducida para realizar tareas de vida diaria (1). La sarcopenia resulta en mayores costos de atención médica de aproximadamente $ 900 por adulto anciano que en los Estados Unidos es de aproximadamente $ 18.5 mil millones por año (2). La prevalencia de la sarcopenia difiere por género, circunstancias vivas y continente: 13.2% de los hombres chinos y el 4.8% de las mujeres chinas que tienen ≥70 años tienen sarcopenia, mientras que el 45-70% y el 7–17.5% de los hombres estadounidenses y 2% –59% y 4–10% de las mujeres estadounidenses tienen sarcopenia, respectivamente, respectivamente (3). La pérdida muscular relacionada con la edad es muy frecuente en hogares de ancianos, con tasas de hasta el 68% en hombres de edad avanzada y el 21% en mujeres mayores (4)mientras que los ancianos que viven en la comunidad tienen tasas de prevalencia más bajas en hombres (10%) pero tasas más altas en mujeres (33%) (5).
Nutrición inadecuada, estrés oxidativo, bajos niveles de actividad física, inflamación y concentraciones hormonales reducidas contribuyen a la pérdida muscular relacionada con la edad (6). Se han investigado activamente las posibles estrategias que aumentan de manera confiable la masa muscular y la fuerza en los ancianos, pero las conclusiones sobre los beneficios de diferentes intervenciones nutricionales, el momento de la administración y el ejercicio físico de los estudios han sido contradictorios. (7)–(20).
Varias intervenciones nutricionales, como monohidrato de creatina, proteína de suero, caseinato y aminoácidos esenciales, parecen aumentar la síntesis de proteínas en los músculos (1), (21), (22). Numerosos estudios han encontrado que estos suplementos nutricionales mejoran la magnitud de la ganancia en la masa corporal magra y la fuerza muscular en adultos mayores que se someten a entrenamiento ejercicio (1), (6), (15). El aminoácido esencial y la suplementación con leucina han aumentado la síntesis de proteínas en los músculos y se cree que son mejores estrategias para compensar la pérdida muscular que la proteína intacta (7), (16), (22)–(24)debido en parte a su mayor absorción (22). Sin embargo, varios estudios que compararon el efecto de la proteína de suero o la suplementación con aminoácidos sobre la masa del músculo esquelético, la masa corporal magra o la fuerza en ancianos sanos con el de los placebos no han detectado una diferencia significativa entre los dos grupos (8), (17).
Muchos de los estudios que evalúan el impacto de la suplementación con proteínas o aminoácidos en la sarcopenia han sido pequeños y han evaluado diferentes suplementos. Para maximizar la potencia bioestática de los ensayos clínicos controlados con placebo, hemos realizado un metaanálisis para evaluar la capacidad de la suplementación con proteínas o aminoácidos para aumentar la masa corporal magra o la fuerza de los músculos de las piernas en pacientes de edad avanzada.
Métodos experimentales
PubMed, Google Scholar, La Biblioteca Cochrane, Embase y ClinicalTrials.gov se registraron desde el inicio hasta el 13 de junio de 2014 utilizando combinaciones de los siguientes términos: envejecimiento, mayor, mayor, pérdida muscular o atrofia, proteínas, aminoácidos. Los criterios de inclusión para el metanálisis requerían que un artículo se publique en una revista revisada revisada por pares que describió un estudio prospectivo o un ensayo controlado aleatorio (ECA) que comparó la eficacia de un suplemento de aminoácidos o proteínas con placebo para mejorar la masa del cuerpo delgado, la fuerza del músculo de las piernas en las personas mayores (≥65 años de edad). Se excluyeron estudios de un solo grupo no controlado, estudios transversales o estudios retrospectivos. También se excluyeron los estudios publicados como cartas, comentarios, editoriales o informes de casos, así como estudios que incluían personas <65 años de edad. Utilizamos la lista de Delphi para evaluar la calidad de los estudios incluidos (25).
Extracción de datos
Se evaluaron los artículos de texto completo para los títulos relevantes para la elegibilidad que incluían estudios que midieron los cambios en la masa corporal magra (LBM), y pueden haber incluido la evaluación de la fuerza muscular de la extensión de la pierna y la prensa de doble pierna. Dos revisores independientes (codificadores) extrajeron la siguiente información de cada estudio elegible: referencia citada, tipo de estudio, tipo y duración de intervenciones, número de participantes en los grupos de intervención y placebo, demografía de participantes (edad, sexo, índice de masa corporal media (IMC)) y valores medios de las medidas de resultado (LBM, resistencia muscular en doble pierna, fuerza muscular en la extensión de la pierna) en la extensión de la lega) en la reas línea de la reanudación. En caso de desacuerdo, un tercer revisor resolvió el problema.
Para evaluar la deriva del codificador, el acuerdo entre los codificadores se calculó dividiendo el número de variables codificadas por el número total de variables. El acuerdo medio de ≥0.90 se consideró aceptable.
Bioestadística
La efectividad del tratamiento se evaluó mediante la comparación de LBM (resultado primario) y la fuerza muscular de la prensa de doble pierna y la extensión de las piernas (resultados secundarios) en sujetos de edad avanzada al inicio y después de la intervención nutricional durante 6 meses (24 semanas). Para la consistencia del tratamiento, solo los estudios que proporcionan suplementos de proteínas se consideraron para el metanálisis. Se calcularon las medias con desviaciones estándar (SD) para LBM, la fuerza muscular media (prensa de la pierna y extensión de la pierna) para cada grupo al inicio y después de la finalización del estudio. La diferencia en el cambio medio (desde el inicio hasta el final del estudio) con un intervalo de confianza del 95% (IC del 95%) se calculó como el cambio medio de la intervención de proteínas (grupo de tratamiento) menos el cambio medio del placebo o los suplementos no nutritivos (grupo de control) para cada resultado.
La heterogeneidad se determinó calculando Cochran Q y la i2 estadística. La estadística Q indicaba heterogeneidad estadísticamente significativa en PAG<0.10. El yo2 La estadística reflejó el porcentaje de la variabilidad entre estudios observada y proporcionó una escala de heterogeneidad: 0 a 24% = sin heterogeneidad; 25 a 49% = heterogeneidad moderada; 50 a 74% = gran heterogeneidad; y 75 a 100% = heterogeneidad extrema. Si existía heterogeneidad entre los estudios (una estadística Q con PAG<0.1 o un i2 Estadística> 50%), realizamos el modelo de efectos aleatorios (método Dersimonian-Laird). De lo contrario, se recomendó el modelo de efectos fijos (método Mantel-Haenszel). Se calculó la diferencia combinada en el cambio medio desde el inicio hasta el final del estudio y un 2 lados PAG El valor <0.05 se consideró para indicar significación estadística. El análisis de sensibilidad se realizó utilizando el enfoque de licencia. El sesgo de publicación solo se evaluó para la masa corporal magra mediante la construcción de parcelas de embudo y tasa de exacerbaciones mediante la prueba de Egger. La ausencia de sesgo de publicación se indica mediante los puntos de datos que forman una distribución simétrica en forma de embudo y un nivel de significancia de una cola P> 0.05 en la prueba de Egger. Todos los análisis estadísticos se realizaron utilizando el metaanálisis integral del software estadístico, versión 2.0 (BioStat, Englewood, NJ, EE. UU.).
Resultados
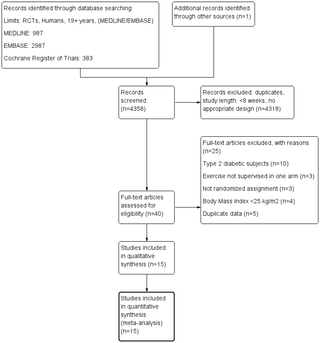
De 1840 estudios identificados por las búsquedas de base de datos, 38 fueron seleccionados para su elegibilidad, y 29 fueron excluidos por una de las siguientes razones: ningún grupo de comparación (n = 1), sin placebo (n = 8), cruzar el diseño (n = 1) o ningún valor para la masa muscular media o la fuerza del músculo de la pierna (n = 19) ((N = 19) ((N = 19) ((N = 19) ((N = 19) (Figura 1). Nueve estudios prospectivos cumplieron con los criterios de inclusión (Figura 1) (8), (17)–(20), (26)–(29).
Todos menos uno de los estudios (18) tenían al menos un 75% que cumplían con la lista de Delphi (Tabla 1). Ocho de los 9 estudios fueron aleatorizados de ensayos clínicos controlados con placebo (8), (17), (19), (20), (26)–(29). Cinco de los ensayos incluyeron un análisis de intención de tratar (8), (20), (26), (27), (29). Los niveles de cumplimiento del 75% al 100% de 8 de los 9 estudios a los criterios de Delphi sugieren que los estudios proporcionaron evidencia de alta calidad. La deriva del codificador se calculó en 0.93, lo que indica una confiabilidad satisfactoria entre los codificadores.
El número de participantes totales en los 9 estudios que habían tomado la intervención fue 267 (rango, 10 a 53) y que habían recibido placebo fueron 244 (rango, 11 a 47). Seis de los 9 estudios proporcionaron un suplemento de proteínas (suero) a 203 participantes de edad avanzada y placebo a 191 sujetos de edad avanzada (controles) (8), (20), (26)–(29)2 estudios suplementaron suplementos de leucina a 54 participantes de edad avanzada y placebo a 42 controles (17), (19)y uno proporcionó aminoácidos esenciales (EAA) a 10 participantes de edad avanzada y 11 controles (18) (Tabla 2). La duración de la intervención varió de 10 días a 6 meses (Tabla 2).
Masa corporal magra
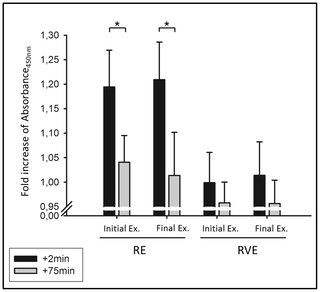
Entre los 6 estudios con suplementos de proteínas (8), (20), (26)–(29)tres informaron que la suplementación nutricional aumentó significativamente LBM en los ancianos en comparación con el placebo (8), (26), (27). Dos estudios observaron una LBM significativamente mayor en los grupos de intervención nutricional y placebo (829). La agrupación de datos de los 6 estudios no reveló heterogeneidad (q = 0.71, df = 5, p = 0.982; i2= 0.0%); Por lo tanto, se usó un modelo de efectos fijos para evaluar la diferencia en el cambio medio en LBM desde el inicio hasta el final del estudio entre los grupos de suplementos de placebo y proteínas. La diferencia en el cambio medio de LBM desde el inicio hasta el final del estudio entre los grupos de suplementos de placebo y proteínas varió de -0.1 a 1.60 kg. La diferencia general en el cambio medio en LBM entre la intervención de tratamiento y el placebo fue de 0.34 kg, lo que no fue significativa (IC 95% = −0.42 a 1.10 kg, p = 0.386, Figura 2).
Abreviación: CI, intervalo de confianza.
Comparamos el estado de salud de los participantes en los 9 estudios para determinar si el estado de salud de los ancianos …