Resumen
La pérdida de masa muscular relacionada con la terapia anticancerígena es una preocupación importante en los pacientes con cáncer, asociado con puntos finales clínicos importantes que incluyen supervivencia, toxicidad del tratamiento y resultados relacionados con el paciente. Investigamos los efectos del ejercicio voluntario durante el tratamiento con cisplatino en el peso corporal, la ingesta de alimentos, así como la masa muscular, la fuerza y la señalización. Los ratones fueron tratados semanalmente con 4 mg/kg de cisplatino o solución salina durante 6 semanas, y se asignaron al azar a la carrera voluntaria o no. El tratamiento con cisplatino indujo la pérdida de peso corporal (29.8%, p <0.001), masa corporal magra (20.6%, p = 0.001), así como anorexia, resistencia muscular deteriorada (disminución del 22.5%, p <0.001) y disminuyó la tolerancia a la glucosa. Además, el cisplatino deterioró los genes inducidos por Akt, inducidos por la degradación e inflamación de las proteínas, y reducido el contenido de glucógeno muscular. La rueda voluntaria que funciona durante el tratamiento atenuó la pérdida de peso corporal en un 50% (P <0.001), mantuvo la masa corporal magra (P <0.001) y la fuerza muscular (P <0.001), la anorexia invertida y los impedimentos en la señalización de degradación de Akt y proteínas. La inflamación muscular inducida por cisplatino no se evitó mediante el funcionamiento voluntario de las ruedas, ni se mejoró la tolerancia a la glucosa. El entrenamiento ejercicio puede preservar la masa muscular en pacientes con cáncer que reciben tratamiento con cisplatino, mejorando potencialmente la capacidad física, la calidad de vida y la supervivencia general.
Antecedentes
La pérdida de la masa muscular es un hallazgo clínico común entre los diagnósticos y las etapas del cáncer atribuibles a una variedad de factores relacionados con el tratamiento contra el cáncer, el estilo de vida del paciente y la enfermedad del cáncer en sí. (1). En ambos pacientes con enfermedad en estadio temprano y avanzado, la masa muscular afecta significativamente los resultados clínicos informados por el paciente, incluida la supervivencia y la progresión de la enfermedad.
El cisplatino es una piedra angular en el tratamiento curativo y adyuvante de varios tumores sólidos, incluidos testiculares, cabeza y cuello, cuello uterino uterino y cáncer de pulmón (2)–(4). El cisplatino es altamente efectivo pero también asociado con la gran cantidad de reacciones adversas, incluidas las náuseas, la anorexia, la disfagia, el dolor y la fatiga, todo lo cual puede estar asociado con disfunción muscular. Los estudios en cultivo de células musculares sugieren que el cisplatino puede inducir genes relacionados con la atrofia, proteólisis proteosomal e inflamación en las células musculares (5), (6).
Actualmente, existe un entusiasmo emergente por las intervenciones de ejercicio en pacientes con cáncer debido a la acumulación de evidencia de efectos beneficiosos sobre la aptitud física, la composición corporal, la fuerza muscular, el rendimiento funcional y el paciente informaron la calidad de vida de la vida. (7)–(9). El entrenamiento del ejercicio estructurado induce una amplia gama de alteraciones bioquímicas que, en circunstancias normales, mejoran las propiedades contráctiles, metabólicas y endocrinas del músculo esquelético (10). Sin embargo, estas adaptaciones inducidas por el ejercicio pueden verse afectadas por la influencia concomitante del cisplatino. Para la antraciclina, se ha demostrado que la doxorrubicina, el ejercicio revierte el estrés oxidativo inducido por doxorrubicina mediante la inducción de enzimas antioxidantes musculares y la proteína de choque térmico 72 (11). La evidencia de tales mecanismos protectores directos del ejercicio queda por determinar para otras quimioterapéuticas, incluida la cisplatino.
Por lo tanto, proponemos que el funcionamiento voluntario de la rueda durante el tratamiento con cisplatino puede mejorar los efectos adversos inducidos por el cisplatino sobre la masa muscular y la función en ratones. Específicamente, investigamos el efecto del ejercicio voluntario durante el tratamiento con cisplatino en el peso corporal, la ingesta de alimentos, así como la masa muscular, la fuerza y la señalización. Además, probamos si hubo una influencia en los resultados del tratamiento antiemético, y si el ejercicio durante la recuperación del tratamiento con cisplatino podría aumentar la restauración de la masa muscular.
Materiales y métodos
Animales y consideraciones éticas
Todos los experimentos con animales se realizaron de acuerdo con las recomendaciones de la Convención Europea para la protección de los animales vertebrados utilizados para la experimentación y después de la aprobación del protocolo experimental por la inspección de experimentos de animales daneses. Todos los experimentos con animales se realizaron de acuerdo con las pautas de llegada (Lista de verificación S1). Para garantizar el bienestar animal, el tratamiento con cisplatino se suspendió si el peso corporal cayó por debajo de los 20 g, para las tasas de finalización, consulte Tabla 1. Los ratones de RMN hembra de ocho a dos semanas de antigüedad (raza propia, felicidad probada) se alojaron en una habitación controlada por temperatura y humedad y se mantuvieron en un ciclo de luz-oscuridad de 12: 12 h con alimentos y agua ad libitumcon 3 ratones por jaula.
Tratamiento de cisplatino y ejercicio voluntario
Los ratones fueron asignados al azar para recibir cisplatino semanal 4 mg/kg (Hospira Nordic, Suecia) o para controlar solución salina durante una duración de 6 semanas. Después de la asignación de grupo inicial, los ratones se aleatorizaron aún más a las jaulas con ruedas en funcionamiento o no. Las distancias promedio de carrera para el Experimento 3 se informan en Fig S1.
Experimento 1: Efecto del cisplatino y el ejercicio.
Sesenta y ocho ratones fueron asignados aleatoriamente a uno de los cuatro grupos: control sedentario (con, n = 16), ejercicio de control (Con+EX, n = 16), cisplatino sedentario (cis, n = 18) y ejercicio de cisplatino (cis+ex, n = 18). Todos los ratones fueron evaluados semanalmente para el peso corporal y la ingesta de alimentos, y al finalizar el período de seis semanas se midieron de la siguiente manera: peso corporal, peso de los órganos y muestreo de sangre al finalizar. Además, la mitad de los ratones se escanearon DXA, realizaron pruebas de ahorcamiento y se realizó una prueba de tolerancia a la glucosa, antes de que se sacrificaran en reposo. La otra mitad de cada grupo de estudio realizó una pelea de natación aguda en agua a 35 ° C antes de la eutanización.
Experimento 2: Efecto de las drogas antieméticas.
Cincuenta y ocho ratones fueron asignados al azar a uno de los seis grupos, tres de los cuales fueron idénticos a los grupos en el Experimento uno: control Sedentary (con, n = 9), cisplatino sedentario (cis, n = 10), ejercicio de cisplatino (cis+ex, n = 10) y tres grupos recibidos antieméticos por inyección de IP durante 3 días concomitantes con cada uno de los 6 semanales cicatinatos. sedentario+ondansetrón 1 mg/kg (Fresenius kabi) (cis+ondansetron, n = 10), cisplatino+sedentaria+dexametasona 5 mg/kg (galen) (cis+dexa, n = 9) o cisplatina+dexametasona+ejercicio (cis+dexa+ex, n, 10). Tres días antes del primero y 7 días después del último tratamiento con cisplatino, todos los ratones fueron escaneados por DXA. Además, el peso corporal y la ingesta de alimentos se monitorearon semanalmente, y se recogieron muestras de sangre al finalizar, 7 días después de la última administración de cisplatino.
Experimento 3: Efecto del ejercicio sobre la recuperación muscular del tratamiento con cisplatino.
Para evaluar la recuperación, seguimos a los ratones para un período de pretratamiento de 6 semanas (pre-CIS), un período de tratamiento de 6 semanas (IC) y un período de seguimiento de 6 semanas (recuperación). Veintisiete ratones fueron asignados al azar a uno de los tres grupos: el control de solución salina sedentaria (con, n = 9), el ejercicio sedentario de cisplatino (cis, n = 9) o cisplatino en el período de recuperación (cis+ex, n = 9). Todos los ratones fueron evaluados semanalmente para la masa corporal y la ingesta de alimentos, y se evaluó adicionalmente para la composición corporal (exploración DXA) antes del período de tratamiento, inmediatamente después del tratamiento del cisplatino y después del período de seguimiento.
Escaneo DXA
La evaluación de la masa corporal lean (LBM) y la masa grasa (FM) se realizaron utilizando un escáner de absptiometría de rayos X de doble energía lunar (DXA) (GE Healthcare Systems, Lunar, Madison WI) con la aplicación de software «Animal pequeño» (Versión de software 8.10). Los ratones se anestesiaron y se colocaron de lado a lado en la tabla de escaneo y escanearon en bloque cinco veces consecutivas. Las regiones de interés (ROI) para el análisis de la composición de todo el cuerpo se ajustaron manualmente una vez alrededor de cada mouse y luego se copiaron a los cuatro escaneos posteriores. LBM y FM medios para cada ratón en un grupo se calcularon a partir de los 5 escaneos consecutivos.
Prueba de colgar
El mouse se colocó sobre un cable suspendido por un período de 3 minutos. Cuando el mouse se cayó del cable, se detuvo el tiempo y el mouse volvió al cable. No se incluyeron caídas deliberadas y accidentales. De una puntuación inicial de 10, cada caída disminuyó el puntaje en 1, y el número total de caídas sobre los 3 minutos se observó como resultado de la prueba (12).
Prueba de tolerancia a la glucosa
Los ratones se ayunaron durante 3 horas y se les dio una inyección IP de glucosa (2 g/kg de peso corporal) para probar la tolerancia a la glucosa (n = 8–9). Se tomaron muestras de sangre de la cola a 0, 15, 30, 60 y 120 minutos después de la inyección de glucosa.
PCR
El ARN total se aisló de muestras de tejido muscular congelado (n = 8) por homogeneización de tejidos y extracción de ARN utilizando el método Trizol (Invitrogen). La pureza y la cantidad del ARN aislado se determinaron mediante un espectrofotómetro de nanodrop (Thermo Scientific). El ARN total (500 ng) se transcribió inversamente en ADN complementario (ADNc) utilizando el kit de transcripción inversa de ADNc de alta capacidad con cebadores hexámeros aleatorios (Applied Biosystems). La amplificación por PCR se monitoreó en tiempo real utilizando la máquina PCR en tiempo real de WIIA7 (Applied Biosystems) y SYBR Green como marcador de fluorescencia (Sybrgreen PCR Master Mix, Applied Biosystem). La cuantificación se realizó normalizando a curvas estándar para cada gen. Los genes objetivo se presentaron como su relación con el ARN 18S ribosómico.
Transferencia Western
Las muestras de tejido muscular se homogeneizaron en un tampón de tris de tris con el uso de Qiagen TissuelySer. Las proteínas se separaron en un criterio de 4–15% en gel prefabricado TGX (Bio-Rad) por electroforesis y se transfirieron a una membrana de difluoruro de polivinilideno (Bio-Rad), utilizando el sistema de transferencia turbo trans-blota a 2.5A-25V durante 10 minutos (Bio-Rad). Después de bloquear con 1% de gelatina de la piel de pescado (Sigma-Aldrich), la membrana se incubó durante la noche a 4 ° C con anti-AKT (señalización celular), anti-fosfo-AKT (Ser473, señalización celular), anti-MTOR (señalización celular) o anti-fosfo-mTOR (Ser24448, señalización de la señalización de la celda en 1% en 1% de peces. Los anti-cuerpos secundarios utilizados fueron inmunoglobulinas anti-Conejo de cabra policlonales conjugadas con HRP (DAKO) en gelatina de piel de pescado al 1%, y las proteínas se visualizaron con una solución súper señal oeste de luminol/potenciador (Thermo Scientific). Las proteínas fueron analizadas por el sistema Chemidoc XRS (Bio-Rad) y el software Cantidad One (Bio-Rad). La tinción inespecífica de proteínas con marrón reactivo (Sigma-Aldrich) se usó como control de carga y transferencia.
ELISA
Las concentraciones de interleucina sérica 6 (IL-6) se midieron mediante un ELISA sandwich (sistemas de I + D). La sensibilidad fue de 6.27 pg/ml y el coeficiente de variación intraensayado fue inferior al 15%. Las concentraciones de grelina sérica se midieron mediante el kit un soloplex de grelina Luminex (Millipore) en muestras de suero del segundo estudio. La sensibilidad fue de 5.18 pg/ml y el coeficiente de variación intraensayado fue inferior al 10%.
Contenido de iones intramusculares y glucógeno
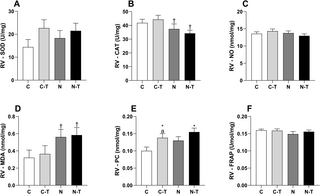
Para el contenido de iones, Total NA+ +K+ + y mg2+ fueron extraídos por ácido tricloroacético y mg2+ El contenido se determinó por espectrofotometría de absorción atómica (Solaar AAS, Thermo), mientras que NA+ + y k+ + se determinaron con un fotómetro de llama del radiómetro FLM3, como se describió anteriormente (13). Para el contenido de glucógeno, los músculos cuádriceps femoríticos (QF) (n = 8) se hidrolizaron ácido en 1 N HCl durante 2 horas en el punto de ebullición y se neutralizaron posteriormente en NaOH 1 N. Las unidades liberadas de glucosilo libre se determinaron espectrofotométricamente utilizando fluoroskan (Ascent, LabSystems) a una longitud de onda de excitación de 355 nm y una longitud de onda de emisión de 460 nm utilizando el software Ascent versión 2.4.
Estadística
Para las comparaciones múltiples, el análisis estadístico se realizó utilizando un análisis de varianza bidireccional (ANOVA de 2 vías) seguido de pruebas post hoc con correcciones Bonferroni. Se usó un ANOVA de 2 vías con medidas repetidas cuando los efectos de los factores experimentales se analizaron en diferentes puntos de tiempo. La significación estadística de la diferencia entre las mediciones (pre-versus posteriores) se obtuvo de una prueba t emparejada de dos colas. El análisis de datos se realizó utilizando GraphPad …