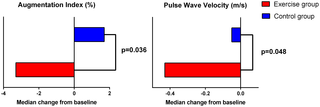
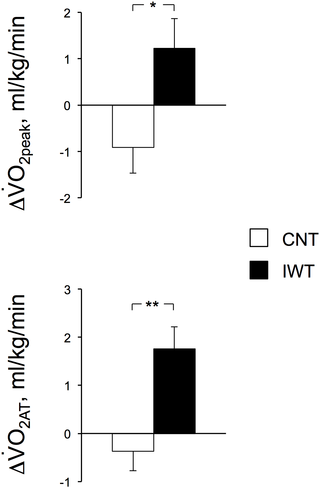
Resumen
Las adaptaciones celulares que ocurren durante la hipertrofia del músculo esquelético en respuesta al entrenamiento de resistencia de alto volumen no están bien caracterizadas. Por lo tanto, buscamos explorar cómo las concentraciones de actina, miosina, proteína sarcoplásmica, mitocondrial y concentraciones de glucógeno se alteraron en individuos que exhibieron hipertrofia media de la sección transversal de fibra esquelética del músculo esquelético (FCSA) después de 6 semanas de entrenamiento de resistencia al alto volumen. Treinta, treinta años previamente entrenados en resistencia, hombres en edad universitaria (media ± desviación estándar: 21 ± 2 años, 5 ± 3 años de entrenamiento) tuvieron biopsias musculares de vasto lateral (VL) obtenidas antes del entrenamiento (pre), en la semana 3 (W3), y en la semana 6 (W6). El tejido muscular de 15 sujetos que exhiben aumentos medios de FCSA de PRE a W6 VL que van desde 320-1600 μm2 se interrogó aún más utilizando varios ensayos bioquímicos e histológicos, así como análisis proteómico. Siete de estos individuos donaron una biopsia de VL después de abstenerse de capacitar 8 días después de la última sesión de entrenamiento (W7) para determinar cómo los biomarcadores afectados por la deltura. Los 15 respondedores hipertróficos de FCSA experimentaron un aumento de +23% en la FCSA media de PRE a W6 (P <0.001) y, mientras que las concentraciones de glucógeno muscular permanecieron inalterados, los niveles de actividad de citrato sintasa disminuyeron en un 24% (P <0.001) que sugiere que el volumen mitocondrial disminuyó. Curiosamente, las ANOVA de medidas repetidas indicaron que los valores p abordaron la significación estadística tanto para la miosina como para la actina (p = 0.052 y p = 0.055, respectivamente), y las pruebas post hoc forzadas indicaron concentraciones para ambas proteínas disminuyeron ~ 30% de pre a W6 (p (p (p (p (p <0.05 para cada objetivo). La tinción de faloidina-actina reveló de manera similar las concentraciones de actina por fibra disminuyeron de pre a W6. El análisis proteómico de la fracción sarcoplásmica de pre a W6 indicó que 40 proteínas estaban reguladas (p <0.05), el análisis KEGG indicaba que la vía de glucólisis/gluconeogénesis estaba regulada por alza (FDR sig. <0.001), y David indicó que los siguientes funcionales funcionalmente- Las vías anotadas se regularon al alza (valor FDR <0.05): a) glucólisis (8 proteínas), b) acetilación (23 proteínas), c) gluconeogénesis (5 proteínas) y d) citoplasma (20 proteínas). En W7, las concentraciones de proteína sarcoplásmica permanecieron más altas que PRE (+66%, P <0.05), y las concentraciones de actina y miosina permanecieron más bajas que Pre (~ -50%, P <0.05). Estos datos sugieren que el entrenamiento de resistencia de alto volumen a corto plazo puede: a) reducir la fibra muscular actina y las concentraciones de proteína de miosina a pesar del aumento de la FCSA, y B) promover la expansión sarcoplásmica coincidente con una regulación ascendente coordinada de proteínas sarcoplasmáticas involucradas en glucólisis y y Otros procesos metabólicos relacionados con la generación de ATP. Curiosamente, estos efectos parecen persistir hasta 8 días después de la capacitación.
Introducción
Semanas o meses de entrenamiento de resistencia aumenta el músculo esquelético Área transversal media de fibra transversal (FCSA) (1–10). Los estudios trazadores también han demostrado que un solo combate de ejercicio de resistencia aumenta la síntesis de proteínas musculares (MP) y las tasas de síntesis de proteínas miofibrilares (MYOPS) hasta 72 horas después del ejercicio (revisado (revisado ((revisado ((revisado ((revisado ((11–13)). El marcador de óxido de deuterio ingerible ha permitido a los científicos medir a MP y MPS integrados para períodos prolongados (14, 15), y los resultados han sugerido que las tasas también son semanas elevadas en el entrenamiento. Dichos hallazgos han llevado a un consenso general de que la hipertrofia del músculo esquelético inducida por el entrenamiento de resistencia ocurre a través de: a) aumento de la acumulación de proteínas miofibrilar a nivel celular, y b) un aumento en el tamaño y el diámetro de la fibra muscular debido a dicha acumulación de proteínas.
Si bien el modelo antes mencionado es lógico, hay estudios en humanos que desafían este modelo. Por ejemplo, un estudio que examinó las alteraciones ultraestructurales de la fibra muscular en humanos en respuesta al entrenamiento isotónico, isométrico y de ejecución informó disminuciones en el número de miofibrillas por área de fibra muscular en todas las condiciones de entrenamiento según lo evaluado por microscopía electrónica de transmisión (TEM) (16). Otro estudio que utiliza TEM (17) El espacio informado de manera similar ocupada por miofibrillas disminuyó y el espacio ocupado por el área sarcoplásmica aumentó en humanos previamente no entrenados después de seis meses de entrenamiento de resistencia en lugar de aumentos significativos en la FCSA. Un estudio similar que utiliza TEM (18) informaron que 18 semanas de entrenamiento de resistencia dieron como resultado una disminución de ~ 15% en el espacio ocupado por miofibrillas en pacientes con insuficiencia cardíaca y controles sanos. Nuestro laboratorio informó recientemente que los machos universitarios no capacitados con altas concentraciones de proteínas miofibrilar de pretrabenamiento, según lo evaluado a través de métodos bioquímicos, experimentaron la mayor disminución en las concentraciones de proteínas miofibrilares después de 12 semanas de entrenamiento de resistencia (19). Por lo tanto, estos hallazgos sugieren colectivamente que la respuesta hipertrófica al entrenamiento de resistencia puede incluir el crecimiento de la fibra a través de la expansión sarcoplásmica (p. Ej., Fluid intracelular, proteínas sarcoplasmáticas y glucógeno) antes de la acumulación de proteínas contráctiles. Tras una revisión exhaustiva de la literatura, recientemente definimos la hipertrofia sarcoplásmica como «…Un aumento en el volumen del sarcolema y/o sarcoplasma acompañado de un aumento en el volumen de mitocondrias, retículo sarcoplásmico, Túbules T, y/o enzima sarcoplásmica o contenido de sustrato«(20). Sin embargo, también notamos una grave falta de investigación en esta área y persuadimos una mayor exploración.
Recientemente publicamos un estudio en el que 31 hombres de edad universitaria bien entrenada completaron 6 semanas de entrenamiento de resistencia de alto volumen bajo diferentes paradigmas nutricionales (21). A la luz de lo anterior, el propósito del estudio actual fue delinear cómo este programa de entrenamiento afectó la actina y las concentraciones de proteínas de miosina, las concentraciones de proteínas sarcoplásmicas, las concentraciones de glucógeno y el volumen mitocondrial en 15 individuos que exhibieron aumentos notables en la FCSA media. Según la literatura de apoyo anterior, planteamos la hipótesis de que las personas que experimentan aumentos notables de la FCSA experimentarían una disminución en las concentraciones de miosina y actina, una disminución en la actividad de la citrato sintasa (indicativo de disminución del contenido mitocondrial), y no hay cambios o un aumento en la proteína sarcoplásmica y el glucicógeno de glicógeno. concentraciones.
Materiales y métodos
Aprobación ética y diseño de estudio
Antes de participar en la recopilación de datos, este estudio fue aprobado por la Junta de Revisión Institucional de la Universidad de Auburn (Protocolo #17–425 MR 1710; Contacto IRB: [email protected]) y conformado con los estándares establecidos por la última revisión de la Declaración de Helsinki. Los machos universitarios entrenados por resistencia de la comunidad local fueron reclutados para participar en este estudio. Los participantes proporcionaron consentimiento informado verbal y por escrito, y completaron un formulario de historial médico antes de la detección. Se utilizaron dos criterios principales para establecer el estado de entrenamiento: a) más de un año de entrenamiento de resistencia (autoinformado), y b) una repetición de una repetición en cuclillas posteriores (1RM) ≥1.5 × masa corporal.
Establecimiento de respondedores medios de la FCSA
Recientemente analizamos secciones musculares en serie de 26 participantes e informamos que el error estándar de medición para detectar los cambios de FCSA en nuestro laboratorio es de ± 459 μm2 (20). De los 31 participantes en el conjunto de datos original, solo 30 participantes produjeron tejido adecuado para inmunohistoquímica, y solo 11 de estos participantes experimentaron> 459 μm2 Aumento de la FCSA media. Por lo tanto, para aumentar el poder estadístico y considerar la naturaleza exploratoria de este trabajo, analizamos las muestras de un total de 15 sujetos que demuestran notablemente positivos, los aumentos medios de FCSA de 320-1600 μm2. En el estudio original, los participantes se dividieron en uno de los tres grupos de suplementos nutricionales que incluyen: a) dosis única diaria de proteína de suero (WP, 25 g/d; n = 10), b) dosis única diaria de maltodextrina (Malto, 30 g/ d; En los 15 participantes que experimentan aumentos medios de FCSA> 320 μm2 Hubo una representación prácticamente igualitaria de los participantes de cada uno de los grupos de suplementos (Malto n = 6, wp n = 4, gwp n = 5) sugiriendo que los resultados probablemente no estaban influenciados por la suplementación nutricional. La edad de entrenamiento de resistencia autoinformada de los 15 respondedores de FCSA fue de 5.5 ± 2.8 años, tres repeticiones máximas (3RM) de la espalda de la espalda antes del estudio fue de 134 ± 22 kg, y la relación masa de 3RM a cuerpo fue de 1.57 ± 0.24 . Los lectores son remitidos a Haun et al. (21) Para descripciones más profundas de los detalles de suplementación y las recomendaciones nutricionales empleadas.
Sesiones de prueba Pre, W3 y W6
Antes de la capacitación (pre), después de la semana 3 (W3), y después de la semana 6 (W6) los participantes llegaron para probar baterías en una condición ayunada durante la noche. En W3 y W6, las sesiones de prueba ocurrieron 24 horas después de los entrenamientos del viernes. Los procedimientos de prueba pertinentes a este conjunto de datos se describen a continuación, aunque otras evaluaciones se realizaron y se describieron con mayor detalle en otra parte (21).
Prueba de gravedad específica de orina para una hidratación adecuada.
Al comienzo de cada sesión de prueba, los participantes presentaron una muestra de orina (~ 5 ml) para evaluar los niveles de gravedad específica de orina (USG) (1.005–1.020 ppm) utilizando un refractómetro de mano (Atago; Bellevue, WA, EE. UU.) Como una medida de estado de hidratación. Se les pidió a los participantes con un USG ≥1.020 que consumieran 400 ml de agua del grifo y se volvieron a ser probados 20 minutos a partir de entonces.
Tisso muscular y recolección de sangre.
Las biopsias musculares se recolectaron usando una aguja de calibre 5 bajo anestesia local como se describió anteriormente (21). Inmediatamente después de la adquisición del tejido, ~ 20-40 mg de tejido se incrustaron en crioMolds que contenían medios de temperatura de corte óptimo (OCT) (Tissue-Tek, Sakura Finetek Inc; Torrence, CA, EE. UU.). La incrustación se realizó de acuerdo con los métodos publicados previamente por nuestro laboratorio (22) mediante el cual se colocó el tejido en crioMolds para la cortación transversal en un estado no estirado antes de la congelación rápida. Luego se congelaron los criomolds usando isopentano líquido refrigerado por nitrógeno y posteriormente se almacenaron a -80 ° C hasta la tinción histológica para la determinación de FCSA y proteína de actina por fibra por fibra como se describe a continuación. El tejido restante se burló de sangre y tejido conectivo, envuelto en láminas prefabricadas, flash congelado en nitrógeno líquido y posteriormente se almacenó a -80 ° C hasta que los análisis moleculares se realizaron como se describe a continuación. Las muestras de sangre venosa también se recogieron en un tubo de separador de suero de 5 ml (Vacutainer BD, Franklin Lakes, NJ, EE. UU.) Durante el período de espera para que la anestesia surtiera efecto para la evaluación de actividad de creatina quinasa (CK) descrita con mayor detalle a continuación.
Protocolo de entrenamiento de resistencia
Los participantes se familiarizaron con el diseño de capacitación y parámetros técnicos durante la prueba de 3RMS que ocurrieron de 3 a 7 días antes de la prueba previa y el inicio de la capacitación. Se emplearon estrictos parámetros técnicos para las pruebas para garantizar reflexiones precisas de fortaleza bajo la supervisión directa del personal de investigación que sostiene la certificación de especialistas en fortaleza y acondicionamiento certificado de la Asociación Nacional de Fuerza y Acondicionamiento.
Después de la batería previa a la prueba y las pruebas de 3RM, RT ocurrió 3 días por semana. Las cargas correspondientes a 60% 1RM, basadas en pruebas 3RM, se programaron para cada conjunto de cada ejercicio. Se programaron conjuntos de 10 repeticiones para cada conjunto de cada ejercicio durante todo el estudio. Los ejercicios se completaron un set a la vez, en el siguiente orden durante cada sesión de entrenamiento: Días 1 y 3 cada semana-Barbell (BB) Sucuración posterior, press de banco BB, peso muerto de patas rígidas y un ejercicio de máquina de cable de agarre bajo mano Diseñado para apuntar a los flexores del codo y los músculos dorsi de late (LAT pulldown); Día 2 de cada semana: BB Back Squat, BB Overhead Press, BB de piernas rígidas y latido lateral LAT. El protocolo de 3 días por semana implicó un aumento progresivo de 10 conjuntos por semana a 32 sets por semana para cada ejercicio. Así, en la última semana de capacitación participantes …