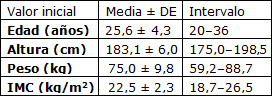Departamento de Nutrición, Ejercicio y Deporte, Facultad de Ciencias, Universidad de Copenhague, Rolighedsvej 30, DK-1958 Frederiksberg, Dinamarca; [email protected] (S.S.H.A.); [email protected] (J.M.F.H.); [email protected] (T.T.H.)
Resumen
INTRODUCCIÓN
La papa es el cuarto cultivo alimentario más producido en todo el mundo; en 2016, la producción total fue de unas 376 millones de toneladas. El consumo de papa es mayor en Occidente, aunque se está convirtiendo en un alimento básico en los países en desarrollo. La relación nutrientes-precio de la papa es, en general, más conveniente que la de muchas otras frutas y vegetales, lo que la convierte en una fuente asequible de nutrientes beneficiosos en cualquier parte del mundo. El almidón es el macronutriente principal de la papa y representa entre el 9,1 % y el 22,6 % del peso de la papa cruda según la variedad. Además de aportar almidón, la papa es una fuente esencial de vitamina C, de distintos tipos de vitamina B y de potasio. También contribuye a la actividad antioxidante, sobre todo si la pulpa es de color. La piel de la papa es una fuente importante de fibra alimenticia vegetal y la pulpa aporta almidón resistente, que comparte algunas propiedades beneficiosas para la salud con la fibra alimenticia. Por último, la papa tiene un alto contenido de agua (entre el 63 % y el 83 % del peso de la papa cruda, según la variedad), lo que resulta en una baja densidad energética si se la compara con otros alimentos ricos en carbohidratos, como la pasta y el arroz. Sin embargo, a pesar de las evidentes propiedades beneficiosas de la papa, en los últimos años se ha debatido con cierta polémica los efectos que tiene sobre la salud. Esto se debe a que muchas variedades de papa tienen, por lo general, un índice glucémico (IG) alto (IG ~77,8). Se ha sugerido que el consumo de alimentos con IG alto aumenta el riesgo de desarrollar sobrepeso, obesidad, diabetes tipo 2 (DT2) y enfermedades cardiovasculares (ECV). Como resultado, algunos científicos recomiendan sustituir la papa con fuentes de almidón de IG bajo, ya sea con otro tipo de alimentos ricos en almidón o con variedades de papa con IG bajo. Se ha propuesto que los alimentos con un IG alto aumentan el riesgo de tener sobrepeso y obesidad porque, entre otras cosas, disminuyen la sensación de saciedad.
El IG ordena los carbohidratos según su efecto en la concentración de la glucosa posprandial de dos horas y se lo define como el área bajo la curva de la respuesta glucémica durante dos horas después de haber consumido, por lo general, 50 g de carbohidratos disponibles en comparación con 50 g de carbohidratos de referencia (glucosa o pan blanco). Tomando como referencia la glucosa, el IG se clasifica en alto si es superior a 70, medio si es de 56 a 69 y bajo si es inferior a 55. Se desarrolló el concepto de carga glucémica (CG) para valorar la cantidad de carbohidratos disponibles que se consumen en una porción de alimentos. Se define la CG como el producto entre el total de carbohidratos disponibles en una porción de comida y el IG de ese mismo alimento.
La CG se clasifica en alta si es superior a 20, media si es de 11 a 19 y baja si es inferior a 10. Por lo general, una porción estándar de papas tiene una CG media (GL ~17.8). Los alimentos con una CG y un IG altos provocarán un aumento rápido y pasajero en la concentración de la glucosa posprandial, mientras que los alimentos con una CG y un IG bajos provocarán una respuesta menor en la glucemia. En consecuencia, los alimentos con una CG y un IG altos estimularán una respuesta a la insulina proporcionalmente mayor, lo que causaría hipoglucemia y una concentración de ácidos grasos ligeramente prematuras en el período posprandial, similar a un estado con poca energía. Este estado de poca energía reduciría la saciedad y aumentaría el hambre después de consumir alimentos con una CG y un IG altos. Sin embargo, la hiperglucemia y la hiperinsulinemia, detectadas inmediatamente después de consumir alimentos con una CG y un IG altos, también producirían saciedad. Con respecto a esto, el análisis de Bornet et al. (2007) y el estudio de Anderson et al. (2002) indican que los alimentos con valores de CG y de IG diferentes simplemente aumentarían la saciedad y reducirían el hambre en distintas etapas del período posprandial.
Al indagar estudios que evalúan la relación entre la papa, la saciedad y el IG, se hallaron resultados que contradicen la postura anterior, es decir, que el consumo de alimentos con un IG alto reduce la saciedad. En el estudio de Leeman et al. (2008), se halló que las papas hervidas generan una sensación de saciedad mayor que las papas fritas cuando se comparan las cantidades isocalóricas, a pesar de que el IG de las papas hervidas era significativamente superior al IG de las papas fritas. Asimismo, no se comprobó que las escalas de saciedad estén asociadas a la respuesta glucémica posprandial. Además, en el estudio de Geliebter et al. (2013) se halló que el puré de papas y las papas al horno generaban una sensación de saciedad y de satisfacción mayor que las cantidades isocalóricas de pasta y de arroz integral en puntos clave medidos desde el inicio. El IG del puré de papas era significativamente superior al de las otras tres comidas y, de nuevo, no se halló ninguna relación entre el IG y las escalas de saciedad o, en este caso, el aporte energético a discreción]. Todos estos resultados indican que otros parámetros además de la CG y del IG son vitales en relación con la saciedad y que en el caso de la papa, la CG y el IG tendrían una influencia leve sobre la saciedad.El objetivo de este estudio fue investigar cómo la papa con
IG bajo afecta las sensaciones subjetivas de apetito cuando se la compara con la papa con IG alto, con la saciedad como el criterio principal de valoración. Según lo expuesto anteriormente, nuestra hipótesis es que las papas con IG bajo y las papas con IG alto no provocarían diferencias significativas en las sensaciones subjetivas de apetito y en el aporte energético a discreción.
MÉTODOS Y MATERIALES
Participantes
En este estudio participaron hombres sanos de entre 18 y 40 años, con un índice de masa corporal (IMC) de 18 a 27. Los criterios de exclusión eran las enfermedades crónicas (diabetes, enfermedades cardiovasculares, u otras enfermedades metabólicas que pudieran afectar los resultados); la toma diaria de medicamentos con receta; el uso diario de suplementos alimenticios que podrían afectar el apetito (que se hayan consumido en el mes anterior al estudio o durante el estudio); fumadores o personas que utilicen productos con nicotina (uso diario durante las tres semanas previas al estudio o durante el estudio); más de diez horas semanales de actividad física intensa; haber participado en otros estudios clínicos (en el mes anterior al estudio o durante el estudio); alergias alimentarias; haber subido o bajado más de 3 kg desde la selección hasta la finalización del estudio, y la incapacidad para cumplir con los procedimientos requeridos por el estudio, como ayunar de 8 a 10 horas antes del estudio. Se seleccionó a los pacientes según criterios de inclusión y de exclusión mediante un cuestionario que se envió por correo electrónico. En el correo también se envió información sobre el estudio y una carpeta del Comité Nacional Danés de Ética en Investigaciones Sanitarias (Danish National Committee on Health Research Ethics), «Forsøgspersoners rettigheder i et sundhedsvidenskabeligt forskningsprojekt». Si se cumplían los criterios de inclusión del cuestionario, se convocaba a los posibles participantes, en grupos de 1 a 3 personas, a una reunión informativa donde se les explicaba, en forma detallada y oralmente, en qué consistía el estudio. En la reunión informativa, los participantes recibieron la carpeta «Før du beslutter dig», también del Comité Nacional Danés de Ética en Investigaciones Sanitarias. Todos los participantes que estaban dispuestos a formar parte del estudio luego de haber recibido la información pertinente tuvieron la oportunidad de ser seleccionados inmediatamente después de entregar su consentimiento informado por escrito. Luego, se evaluó a cada participante según los criterios de inclusión y de exclusión, que incluían datos de la altura (medida con un estadímetro montado en la pared de marca Hultafors, con una precisión de 0,5 cm, Hultafors Group Danmark A/S, Ballerup, Dinamarca) y del peso corporal (medido con una balanza Tanita BWB-600 y redondeado a la centena más próxima, Tanita Corporation of America, Inc., Arlington Heights, IL, EUA). Se anotaron todas las respuestas y las medidas en el cuaderno de recogida de datos (CRD). Una vez que fueron admitidos en el estudio, a cada participante se le asignó un número individual. El estudio se registró en clinicaltrials.gov (NCT03512509) y se llevó a cabo según la Declaración de Helsinki de 1975 (revisada en 1983). El comité de ética decidió que el estudio no requería aprobación ética ya que se utilizaron alimentos normales como alimentos prueba y no se tomaron muestras biológicas.
Diseño experimental
El estudio se planificó como un estudio simple ciego aleatorizado con grupos cruzados y con dos condiciones experimentales; se llevó a cabo en el Departamento de Nutrición, Ejercicio y Deporte, Universidad de Copenhague, Dinamarca. El reclutamiento comenzó en febrero de 2018 y el estudio finalizó en abril de 2018. Los pacientes se distribuyeron de manera aleatoria para recibir cantidades isocalóricas de papa con un IG bajo (Carisma®, Emmeloord, Países Bajos) o con un IG alto (Arizona, Emmeloord, Países Bajos) en el desayuno del primer día del estudio. Los dos días del estudio, los pacientes llegaron al centro de pruebas a las 08:00 en ayunas (8-10 horas). Se pesaron y respondieron preguntas de control predefinidas para asegurar que todavía fueran elegibles para el estudio. Las preguntas eran las siguientes: «¿Qué medio de transporte utilizó para venir?», «¿Practicó algún deporte durante las últimas 48 horas?», «¿Bebió alcohol durante las últimas 48 horas?», «¿Su estilo de vida cambió de manera radical en el último mes?», «¿Tomó algún medicamento o algún suplemento alimenticio durante el último mes?» y «¿Ayunó de 8 a 10 horas antes de venir?». Se registraron todas las respuestas en el CRD. Luego, se condujo a los pacientes a la sala de pruebas donde 5 minutos antes de comenzar (08:55) completaron la primera escala analógica visual (EAV) para evaluar las sensaciones subjetivas de apetito. En el minuto 0 (09:00), recibieron los alimentos prueba asignados, que debían consumir en 15 minutos. 15 minutos después, completaron la segunda EAV. Los participantes también completaron EAV 45, 75, 105 y 135 minutos después de iniciar la prueba. En total, se completaron seis EAV por día. Dos horas y media (150 minutos) después de servir el alimento prueba, se les sirvió una comida a discreción (pizza), que debieron consumir en 30 minutos. De ahí en adelante, se pesó lo que quedó de pizza y se registró el consumo energético. Se eligió un intervalo de dos horas y media para garantizar que los participantes no sintieran mucha hambre y que la sensación de satisfacción del alimento prueba no desapareciese antes de servir la comida a discreción. Durante los días del estudio, los participantes podían utilizar computadoras y teléfonos celulares y hablar entre ellos, siempre y cuando las actividades no estuviesen relacionadas con comidas, no se hablase del estudio o no se realizase actividad física. Por último, todos los participantes tuvieron al menos un período de reposo de siete días entre los dos días del estudio.
Estandarización
Se les indicó a los participantes que 48 horas antes del estudio no realizasen actividad física intensa, que no consumiesen grandes cantidades de alcohol (más de una medida), que tuviesen una alimentación normal y que continuasen con sus rutinas habituales. También se les indicó que ayunasen de 8 a 10 horas antes de llegar al centro, pero podían tomar agua. Además, los participantes llegaron al centro por sus propios medios, pero se les pidió que realizasen la menor cantidad de actividad física posible. Podían utilizar la bicicleta durante no más de treinta minutos y a un ritmo lento si esta era su medio de transporte habitual. El primer día del estudio, todos los participantes recibieron una copia de sus respuestas a las preguntas de control y se los alentó a repetir esas conductas antes del segundo día.
Alimentos prueba
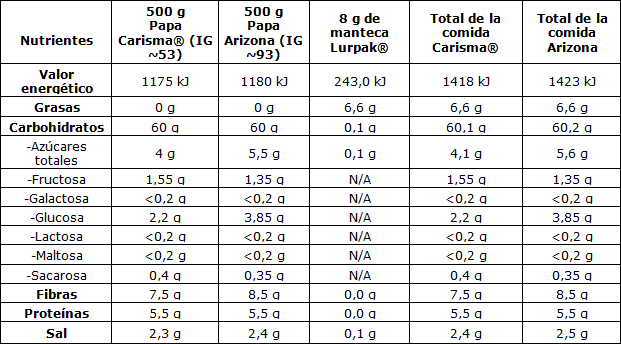
La firma Agrico (Emmeloord, Países Bajos) proporcionó las papas que se utilizaron en el estudio junto con los valores de los IG correspondientes y las instrucciones acerca de cómo cocinarlas. Se eligió la variedad de papa Carisma® como la papa con un IG bajo (IG ~53) y la variedad de papa Arizona como la papa con un IG alto (GI ~93). Como parte de su trabajo interno, Agrico había medido los valores de los IG de las papas en un laboratorio independiente certificado en Singapur. Las muestras de papa para el análisis de los IG se prepararon según las instrucciones provistas por Agrico. Las instrucciones se siguieron al pie de la letra y, por lo tanto, se consideraron los valores representativos de los IG de los alimentos prueba que se sirvieron en este estudio. Los alimentos prueba consistían en 500 g de papa rebanada y cocinada de la variedad con IG bajo o alto. Las papas se lavaron y se cortaron con una mandolina de hierro en rebanadas de 5 mm de espesor. Se descartaron los extremos para que la comida fuera más pareja. Se prepararon ~510 g de la papa asignada por participante. Las papas se colocaron en una olla con 3 l de agua a 37 °C y 24 g de sal por kilogramo de papa. Luego, se taparon las ollas y se encendieron las hornallas. Cuando el agua comenzó a hervir, se destaparon las ollas y las papas se cocinaron durante cuatro minutos. Inmediatamente después, se tiró el agua y se pesaron porciones de 500 g de papa en los platos para servir y se las cubrió con 8 g de manteca común de marca Lurpak® Salted, Arla Foods amba, oficina central Viby J, Dinamarca. Se cubrieron los platos y se los sirvió a los participantes. Los participantes también recibieron un vaso de agua (250 g ± 1 g). Se les indicó a los participantes que comiesen todo el alimento prueba y que tomasen toda el agua. Debían consumir el alimento prueba en 15 minutos, de manera tal que comiesen el último bocado en el último minuto. Los alimentos prueba eran isocalóricos (~1420 kJ) y tenían un contenido similar de macronutrientes (ver Tabla 1). Toda la comida se pesó con una balanza Sartorius BP6100 Basic Plus Balance (d = 0,1 g) (Sartorius Corporate, Goettingen, Alemania). Antes de comenzar el estudio, se prepararon muestras de ambas variedades de papa con el mismo método empleado en los días que duró el estudio, y se las envió al laboratorio independiente Eurofins (Eurofins Steins Laboratorium A/S, Vejen, Dinamarca), donde se les realizó un análisis nutricional (ver Tabla 1). En el análisis nutricional realizado por Eurofins no se determinó la cantidad exacta de almidón resistente presente en ambas variedades de papa. Se lo consideró parte del total de carbohidratos disponibles.
Tabla 1. Composición de las comidas con papa.
Contenido nutricional de papas rebanadas y cocinadas analizadas después de enfriarse por el laboratorio independiente Eurofins. Contenido nutricional de la manteca Lurpak® (salada) según la información del envase. Valores de IG brindados por Agrico. Índice glucémico, IG, N/A, sin información disponible.
Comida a discreción
La comida a discreción consistió en pizza congelada de mozarela «Ristorante Pizza Mozzarella» de Dr. Oetker (Dr. Oetker Dinamarca A/S, Glostrup, Dinamarca), elegida por su homogeneidad. Se sacaron las pizzas del frízer 40 minutos antes de servirlas y poco antes de servirlas se hornearon durante 10 min a 200 °C en un horno industrial precalentado (Rational, SelfCookingCenter, 5 Senses). Se colocó las pizzas en una bandeja y se las pesó. A cada participante se le sirvió una bandeja con tres pizzas (aproximadamente ~10,500 kJ en total), tijeras y un vaso de agua (250 g ± 1 g). Se utilizaron tijeras para que cada participante tuviera que cortar de manera consciente una nueva porción de pizza en lugar de tener porciones ya cortadas y listas para comer. Se les indicó a los pacientes que tomasen toda el agua, que comiesen el borde de la pizza y que comiesen hasta sentirse satisfechos. Después de comer, las bandejas se llevaron a la cocina, se pesó el sobrante de pizza en cada bandeja y se calculó la energía consumida por cada participante (Tabla 2).
Tabla 2. Composición de las comidas a discreción.
Contenido nutricional de la pizza según la información del envase (Dr. Oetker).
Medida del apetito subjetivo
La saciedad subjetiva, el hambre, la plenitud y el posible consumo de alimentos se midieron con una EAV electrónica de 100 mm. Se validó la versión electrónica de la EAV en comparación con la versión en lápiz y papel. Se utilizó el programa Evascale© para crear las preguntas y las líneas de la EAV de 100 mm. En cada extremo de la línea de 100 mm se colocó la respuesta más positiva y la respuesta más negativa a la EAV. Cada día del estudio, los participantes recibieron su propia tableta conectada a su número de participante. Cada participante respondió un total de seis EAV. En cada una de las EAV, las cuatro preguntas estaban programadas para aparecer de manera aleatoria y así asegurar que los participantes leyeran y consideraran todas las preguntas en cada ocasión. Se les indicó a los participantes que leyeran las preguntas con detenimiento y que respondieran lo primero que pensasen. Las preguntas eran las siguientes: «¿Cuán satisfecho se siente?», «¿Cuánto hambre siente?», «¿Cuán lleno se siente?» y «¿Cuánto cree que podría comer?» Las posibles respuestas variaban desde «Me siento completamente vacío» hasta «No podría comer un bocado más»; desde «No tengo hambre» hasta «Tengo mucha hambre»; desde «No me siento lleno» hasta «Me siento completamente lleno» y desde «No puedo comer nada» hasta «Puedo comer mucho».
Aleatorización y enmascaramiento
Los subinvestigadores indicaron a los participantes que comenzasen con uno de los dos alimentos prueba utilizando un generador de números al azar en random.org/integer-sets/. Solo los participantes desconocían la distribución de los alimentos, ya que los subinvestigadores prepararon los alimentos prueba y analizaron todos los datos. A cada variedad de papa se le asignó una letra —A para la variedad Carisma® y B para la variedad Arizona— que luego se utilizó en la cocina para asegurarse de que cada participante recibiera el alimento prueba correspondiente. Una vez que se sirvieron los alimentos, las bandejas se identificaron solo con el número del participante. Una vez rebanadas y cocinadas, las papas tenían la misma textura, el mismo sabor y la misma apariencia, por lo que no había más motivos para evitar que los participantes supiesen qué variedad se les había asignado.
Potencia estadística
Se siguió el estudio de Flin et al. (2000) para determinar el tamaño de las muestras para las sensaciones de apetito. Según este estudio, se puede detectar un tamaño del efecto del 5 % para las clasificaciones del valor medio del criterio principal de valoración (la saciedad) y de los criterios secundarios de valoración (hambre, plenitud, y posible consumo de alimentos) cuando se incluyen 18 participantes y se realiza un estudio emparejado (α = 0,05, β = 0,80). Para obtener una potencia estadística de 0,8 en el criterio secundario de valoración (consumo energético a discreción), se necesitarían unos 26 participantes, según el tamaño del efecto.
Análisis estadístico
Todos los análisis estadísticos se realizaron en R versión 3.3.2 (R Core Team, 2016, Viena, Austria) con Rstudio (versión 1.1.442-© 2009–2018 RStudio, Inc., Boston, MA, EUA). La corrección inicial de datos de los valores de las EAV se llevó a cabo mediante una inspección visual de todas las curvas individuales utilizando los llamados «códigos espagueti». Se discutieron las medidas de las EAV que no estaban comprendidas en la desviación estándar de ±3 y se consideró excluirlas. Los datos incompletos se incluyeron en todos los análisis. Las características iniciales se muestran como media ± desviación estándar (DE). Se utilizaron modelos lineales mixtos ANCOVA para analizar las diferencias en el área incremental bajo la curva (AIBC) y en el área incremental sobre la curva (AISC), así como las mediciones reiteradas de las sensaciones subjetivas de apetito y los datos a discreción. Los modelos AIBC, AISC y a discreción se ajustaron según la edad, el IMC, el día de visita y el orden de las comidas. Los modelos para las mediciones reiteradas de las sensaciones subjetivas de apetito incluían una interacción tiempo-comida y se ajustaron según la edad, el IMC, el día de visita, el orden de las comidas y los valores en ayunas el día del estudio. No se aplicaron ajustes por multiplicidad. Se estableció la significación estadística con un nivel de significación de 0,05.
RESULTADOS
Participantes
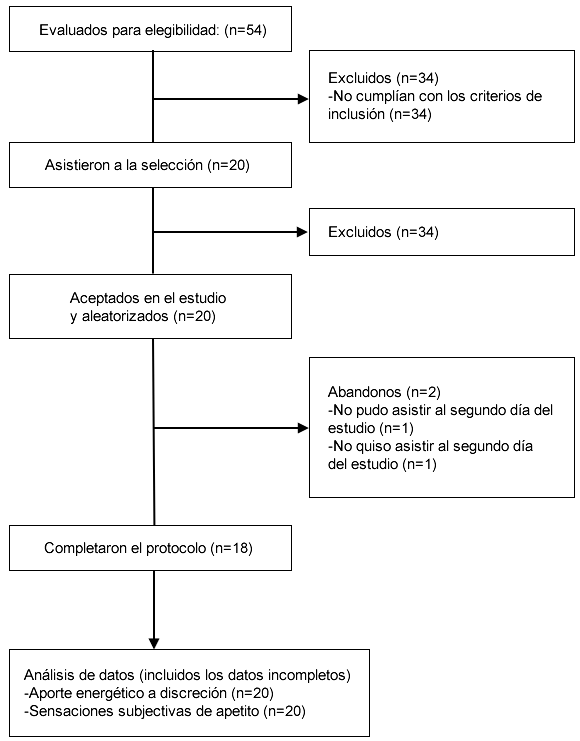
Un total de 54 individuos respondieron a nuestro material de reclutamiento, 34 de los cuales no cumplían con el criterio de inclusión. Los 20 hombres restantes asistieron a la visita de selección y los 20 fueron evaluados como elegibles e incorporados al estudio. Las características iniciales de los participantes se muestran en la tabla 3.
Tabla 3. Características iniciales
Acorde con las medidas realizadas en la visita de selección. DE: desviación estándar; IMC: índice de masa corporal.
Dos personas abandonaron. Un participante completó el primer día del estudio, pero no pudo organizar sus horarios para asistir al segundo día. Otro participante no mostró interés en completar el segundo día del estudio por razones desconocidas (Figura 1).
Figura 1. Esquema de los participantes
Sensaciones subjetivas de apetito
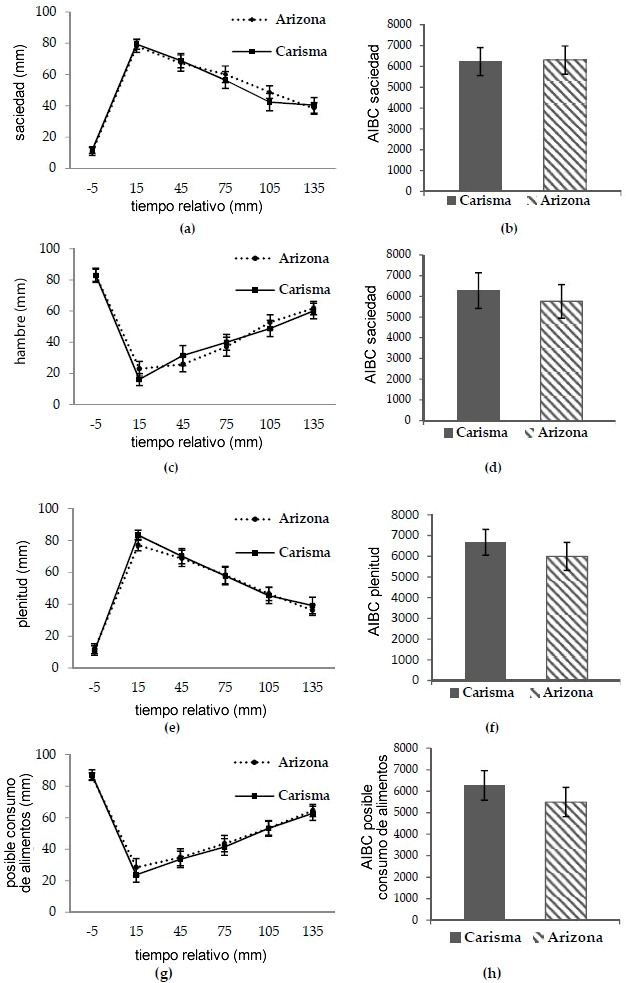
Los reiterados análisis de las medidas del criterio de valoración primario (la sensación subjetiva de saciedad) no mostraron una diferencia significativa en la interacción tiempo-comida (p = 0,847) o en el efecto de la comida (p = 0.819) entre las comidas con los dos tipo de papa. (Figura 2 a). Asimismo, no se halló una diferencia significativa en el AIBC de la saciedad subjetiva (p = 0.737) entre las comidas con los dos tipos de papa. (Figura 2 b).
No se hallaron diferencias significativas en la interacción tiempo-comida o en el efecto de la comida para los criterios de valoración secundarios (hambre, plenitud y posible consumo de alimentos) entre las comidas con los dos tipos de papa. (Figura 2 c, e, g). Tampoco se hallaron diferencias significativas en el AIBC y en el AISC del hambre (p = 0,213), la plenitud (p = 0,361) y el posible consumo de alimentos (p = 0,145) entre las comidas con los dos tipos de papa. (Figura 2 d, f, h).
Figura 2. Curvas medias ajustadas de la saciedad (a), el hambre (c), la plenitud (e), el posible consumo de alimentos (g) y las correspondientes áreas incrementales bajo la curva o sobre la curva. (AIBC/AISC) (b), (d), (f) y (h). Los datos se muestran como media ± DE. p > 0,05 para todos los casos (valor p ajustado). Carisma® (IG bajo) y Arizona (IG alto). EE: error estándar; IG: índice glucémico.
Aporte energético a discreción
No se hallaron diferencias significativas en el aporte energético a discreción entre los dos grupos de estudio (p = 0,105). (Figura 3). Medias ± desviación estándar ajustadas de la variedad Carisma® = 5944,0 ± 255,0 kJ y de la variedad Arizona = 6321,1 ± 245,3 kJ (∆ 377,1 ± 232,3 kJ). La ausencia de diferencias (p = 0,251) se confirmó aun más cuando se descartó un valor atípico (diferencia en el aporte energético a discreción fuera de la desviación estándar de ± 2).
Figura 3. Medias sin ajustar del aporte energético a discreción ± DE. Todos los valores de p = 0,105 (valor p-ajustado). Carisma® (IG bajo) y Arizona (IG alto). EE: error estándar; IG: índice glucémico.
Aporte energético (kJ)
Comentarios
En este estudio no se hallaron diferencias significativas en el criterio primario de valoración, la saciedad subjetiva, entre las dos variedades de papa (p > 0,05 para todos los casos). Tampoco se hallaron diferencias significativas entre los criterios secundarios de valoración —hambre, plenitud, posible consumo de alimentos o aporte energético a discreción (p > 0,05 para todos los casos). Esto confirma nuestra hipótesis de que las papas con IG bajo y las papas con IG alto no provocan diferencias significativas en las sensaciones subjetivas de apetito o en el aporte energético a discreción.
La regulación del apetito se estimula mediante diversas señales centrales y periféricas en respuesta al balance energético y a la composición del alimento consumido. Estas señales se procesan, principalmente, en el tronco encefálico y en el hipotálamo, donde estimulan diferentes neuronas que aumentan o disminuyen el consumo de alimentos. Sin embargo, las sensaciones hedónicas, los estímulos sensoriales y ambientales, y los factores emocionales modifican en gran medida estas señales centrales y periféricas, por lo que la regulación del apetito es un asunto complejo. Para evaluar si el IG de un determinado alimento es relevante como el único parámetro relacionado con la saciedad subjetiva, habría que controlar los siguientes factores: composición de los macronutrientes, densidad energética, volumen, tamaño de la porción, palatabilidad y contenido de fibra del alimento para consumir, y realizar, de ser posible, un estudio con grupos cruzados. En nuestro caso, controlamos estos parámetros al elegir dos variedades de papa cuyo contenido nutricional, textura, sabor y apariencia son similares, y al realizar un estudio con grupos cruzados.
Debido a que se controlaron los parámetros mencionados anteriormente y a que en el estudio no se hallaron diferencias significativas entre la saciedad subjetiva o entre cualquiera de los criterios secundarios de valoración, los resultados no avalan la noción de que las papas con IG alto disminuyen la saciedad en comparación con las papas con IG bajo.
Los resultados de los estudios de Leemann et al. (2008) y de Geliebter et al. (2013) confirman nuestros hallazgos. Como ya se mencionó, tampoco se encontró una relación entre la saciedad y el IG cuando se analizó la saciedad luego de consumir diferentes comidas con papa, pasta y arroz integral. Por otro lado, Geliebter et al. (2013) no hallaron una relación entre el IG y el aporte energético a discreción. En un estudio de Erdmann et al. (2007), se analizó el efecto de cantidades satisfactorias de papas hervidas, arroz y pasta, que se sirvieron con 150 g de cerdo, para establecer, entre otras cosas, escalas de saciedad, el consumo de alimentos y la concentración plasmática de insulina y de glucosa. Los resultados mostraron que, mientras que las papas hervidas, el arroz y la pasta dieron lugar a cantidades similares de consumo de alimentos y a escalas de saciedad también similares, la comida con papa produjo a un aporte energético significativamente menor que el de las otras dos comidas (papa = 2177 kJ; pasta = 3174 kJ; arroz = 2829 kJ). Esta diferencia en el aporte energético no afectó el aporte energético de la comida a discreción. Así, los participantes ingirieron, en total, menos energía cuando consumieron la comida con papa. La respuesta glucémica fue mayor luego de ingerir arroz, seguida de la papa y de la pasta (todas diferencias no significativas), mientras que las papas provocaron un aumento significativamente menor en la insulina que la pasta y el arroz. En un estudio reciente de Akilen et al. (2016), se hallaron resultados similares en niños. En general, estos resultados indicarían que la cantidad de alimento es una variable más importante que la respuesta hormonal para establecer escalas de saciedad. Los resultados de Erdmann et al. (2007) y de Akilen et al. (2016) indicarían que la baja densidad energética de la papa sería una propiedad saciante notoria de este alimento; se pueden consumir grandes cantidades de papa con relativamente pocas calorías según la forma en la que se las prepare. En el estudio de Holt et al. también se halló que la densidad energética es un factor sustancial para la saciedad (1995). Crearon un índice de saciedad (IS) basado en las escalas de las sensaciones de apetito luego de ingerir 1000 kJ de diferentes tipos de comida. Los autores hallaron que el tamaño de la porción de los alimentos prueba era la variable más importante para los valores del IS (no se midió el IG). De todos los alimentos incluidos en el estudio, las papas hervidas generaban los valores de IS más altos (323 ± 51). Como muchos de los alimentos incluidos en el estudio tenían, en general, un IG menor que las papas hervidas, por ejemplo, lentejas (IG ≈35,2), arroz integral (IG ≈46,5) y pasta integral (IG ≈48.3), esto cuestiona nuevamente el rol del IG de la papa con relación a la saciedad. Algunos estudios a corto plazo no enfocados en la papa confirman que no hay relación entre el IG de un alimento y la saciedad, mientras que otros estudios de este tipo muestran una correlación inversa entre el IG y la saciedad, es decir, que los alimentos con un IG bajo producen más saciedad que los alimentos un IG alto. En ninguno de los estudios mencionados anteriormente se pudo controlar los parámetros descritos como se hizo en nuestro estudio, ya que se comparaban diferentes tipos de alimentos, comidas y modos de preparación. Además, se investigaron distintos grupos poblacionales. En cierta medida, esto podría explicar los resultados contradictorios que se mencionaron, pero como los estudios no se centraban en la papa, los resultados también indicarían que el rol del IG podría variar entre diferentes tipos de alimentos y combinaciones.
También se observaron resultados contradictorios en estudios a largo plazo que no se centraban en la papa, por ejemplo, en el análisis de Esfahani et al. (2011). En este análisis se incluyeron 23 ensayos clínicos en los que se comparaba una dieta con IG bajo con una dieta con IG alto y su relación con la pérdida de peso. En 7 de los 23 ensayos clínicos se demostró que una dieta con IG bajo provocaba una pérdida de peso mayor que una dieta con IG alto. En el resto de los 18 ensayos no se hallaron diferencias significativas. Sin embargo, 12 de estos ensayos favorecieron las dietas con un IG bajo y 4, las dietas con un IG alto. En el análisis, se halló una variabilidad significativa entre lo que se consideraba una dieta con un IG y una dieta con un IG alto, y la mayoría de los estudios no ajustaron los macronutrientes y el contenido de fibra de las dietas. Esta variabilidad en las dietas con IG alto y bajo dificulta la comparación de los resultados entre los estudios, y la falta de estandarización de los propios estudios indicaría que los resultados contradictorios se deben a otros parámetros importantes para la saciedad. Los resultados de los ensayos aleatorizados y controlados de Sacks et al. (2014), Aston et al. (2007), y Sloth et al. (2004) confirman esta postura. En estos estudios, se compararon los efectos de una dieta con IG bajo con los de una dieta con IG alto. Los criterios de valoración de Sacks et al. (2014) eran criterios cardiovasculares y diabéticos; Aston et al. (2007) se enfocaron en el apetito y en la pérdida de peso, mientras que Sloth et al. (2004) se enfocaron tanto en criterios de valoración cardiovasculares y diabéticos como en la pérdida de peso. Las dietas en el estudio de Sacks et al. (2014) se ajustaron en la composición de los macronutrientes y en el contenido de fibra y de energía, mientras que las dietas en los estudios de Aston et al. (2007) y Sloth et al. se ajustaron en la composición de macronutrientes, en el contenido de fibra y en la densidad energética para la evaluación a discreción. Así, el IG era la diferencia principal entre las dietas en los tres estudios. Los resultados de estos estudios no muestran una diferencia general entre la mayoría de los criterios de valoración al comparar las dietas con IG bajo con las dietas con IG alto, salvo en el estudio de Sloth et al. donde se halló una disminución significativa en la concentración de lipoproteínas de baja densidad y en el estudio de Sacks et al. (2014) donde se halló un disminución significativa de triglicéridos cuando se consumía una dieta con IG bajo en comparación con el consumo de una dieta con IG alto. En un estudio de Krog-Mikkelsen et al. (2011), se analizó un subgrupo de los participantes del estudio de Sloth et al. (2004) en un diseño que consistía de una sola comida. Se les sirvió un desayuno con un IG alto o bajo para evaluar, entre otras cosas, las sensaciones subjetivas de apetito y el aporte energético a discreción después de consumir durante 10 días una dieta con un IG alto o bajo, según corresponda. La única diferencia entre las comidas era el IG, ya que tenían la misma composición de macronutrientes, la misma densidad energética, la misma cantidad de fibra y el mismo contenido energético. Los resultados de este estudio no mostraron una diferencia significativa en las sensaciones posprandiales de saciedad, hambre y posible consumo de alimentos, pero sí mostraron una interacción del tipo tiempo-comida en las escalas de plenitud. La plenitud era significativamente mayor (p = 0,01) luego de haber consumido los alimentos con IG bajo. No se hallaron diferencias en el aporte energético a discreción entre los dos grupos durante el almuerzo. En términos generales, los resultados del estudio de Krog-Mikkelsen et al. (2011) no indican que una dieta con IG alto disminuya la saciedad con el tiempo.
Todos estos resultados no solo cuestionan el rol del IG de la papa en relación con la saciedad, sino que también cuestionan el rol que tiene el IG en general en relación con la saciedad.
Como ya se mencionó, se cree que los alimentos con un IG alto reducirían la saciedad ya que luego de consumirlos se genera un estado de poca energía. En el estudio de Flint et al. (2006) y en el metanálisis de Flint et al. (2007) se cuestiona esta hipótesis; en ambos se muestra que la insulina, y no la glucosa, está asociada con las sensaciones de apetito a corto plazo. Por lo tanto, se asoció una mayor concentración de insulina después de las comidas con una disminución en el apetito y con un aumento en la saciedad. Suponiendo que el IG era la única diferencia entre las dos comidas que se sirvieron en nuestro estudio debido a la estandarización, nuestro análisis no confirma que la insulina o la glucosa sean un factor preponderante en relación con la saciedad que genera la papa, ya que no se encontró en ningún momento una interacción significativa entre el tiempo y la comida en las papas con IG bajo y alto. Por la misma razón, nuestros resultados no confirman que valores diferentes de IG incrementarían la saciedad y disminuirían el hambre en distintos momentos del período posprandial, como sostienen Bonet et al. (2007) y Anderson et al. (2002). Sin embargo, hay que mencionar que en nuestro estudio no se midió la respuesta glucémica ni la insulina luego de ingerir las comidas y que por lo tanto dependemos exclusivamente de los valores de los IG provistos por Agrico. Así, nuestros resultados indicarían que otros parámetros además de la insulina y de la glucosa serían más importantes en relación con la saciedad que genera la papa. Uno de estos parámetros podría ser la densidad energética relativamente baja de la papa. La cantidad de comida ingerida estimula la saciedad mediante la distensión y la llenura gástricas, las cuales son mecanismos esenciales en la activación de las señales de saciedad. Otro factor que podría convertir a la papa en un alimento que genera saciedad es el contenido de inhibidores de la proteasa II (IP2). Este inhibe la actividad de la enzima preptidasa trisina en el intestino delgado y, en consecuencia, prolonga la actividad de la pancreocimina, hormona de la saciedad. No obstante, el efecto del PI2 podría quedar oculto por otras proteínas presentes en la papa.
Los resultados contradictorios sobre este tema están acompañados por varios puntos de desafíos metodológicos, que deben considerarse al evaluar el uso del IG en las recomendaciones nutricionales. Un aspecto importante que hay que tener en cuenta es la gran variación intraindividual e interindividual entre las medidas del IG, como se mencionó en el estudio de Vega-Lopez et al. (2007). Otro punto para tener en cuenta es el efecto de las comidas mixtas en el valor estimado del IG de una comida. Mientras que algunos resultados indican que el IG de los componentes individuales puede utilizarse para predecir el valor del IG de una comida, un estudio reciente demostró que el valor calculado del IG de una comida mixta estaba sobrestimado cuando se lo comparaba con el valor medido del IG. El contenido de grasas y de proteínas de dicha comida mixta podría explicar esto, ya que se cree que tanto las grasas como las proteínas reducen el ritmo del vaciamiento gástrico al estimular las hormonas intestinales, como la pancreocimina, y así se reduce el impacto glucémico de una comida. Esto es importante porque muchos alimentos, como la papa, suelen consumirse como parte de una comida mixta. También es necesario considerar la CG de un alimento, ya que tiene en cuenta la porción estándar que normalmente se consume. En este sentido, la papa en general tiene una CG media, lo que produce un impacto glucémico menor que la papa con IG alto.
Cuando se interpretan los resultados del presente estudio, hay que considerar distintos aspectos. A pesar de que nuestro estudio aísla muy bien el efecto del IG, no representa una comida mixta típica y el tamaño de la porción de las comidas con papa era más grande que una porción habitual de papas. Además, no es común consumir papas durante el desayuno en Dinamarca. Todo esto puede haber afectado las sensaciones subjetivas de apetito y el aporte energético a discreción, y así opacar en parte el efecto del IG. Hubiera sido conveniente conocer la cantidad exacta de almidón resistente en cada variedad de papa, puesto que se sabe que el almidón resistente afecta el IG de una comida y se ha demostrado que afecta la saciedad sin relacionarse con el IG. Esto último podría, nuevamente, opacar en parte el efecto del IG. Por otra parte, todos los participantes eran hombres, lo que limita los resultados a este género. Se eligieron hombres para tener un grupo experimental homogéneo y porque el ciclo menstrual de las mujeres puede afectar las sensaciones de apetito y el aporte energético. Asimismo, todos los participantes tenían un peso corporal relativamente normal (IMC de 18 a 27) y los resultados podrían diferir en participantes obesos o con sobrepeso, ya que el IG podría tener efectos diferentes en individuos con prediabetes y resistencia a la insulina, como muestran los estudios de Hjorth et al. (2017) y Hjorth et al. (2017). Otro aspecto que hay que considerar es que, como ya se mencionó, los valores de los IG provistos por Agrico deberían representar muy bien nuestros alimentos prueba debido a la estandarización de los métodos de preparación. No obstante, si hubiésemos medido la respuesta glucémica nosotros mismos, habría aumentado la validez de nuestro estudio y se habrían validado los valores de los IG provistos por Agrico. El método de preparación y la composición de toda la comida que se sirve afectan el IG de las papas y, en general, de los alimentos ricos en almidón. Es esencial tener en cuenta esto cuando se utilicen valores publicados de IG en un diseño de un estudio. Así, los investigadores siempre deberían utilizar valores representativos de IG, como se hizo en este estudio. Otro punto para considerar es que nuestro estudio solo evalúa los efectos a corto plazo del IG de la papa sobre la saciedad, mientras que la saciedad a largo plazo tendría una importancia mayor en el riesgo de padecer sobrepeso y obesidad. Por último, es necesario mencionar que la disminución en la saciedad es solo una hipótesis acerca de cómo los alimentos con IG alto aumentarían el riesgo de tener sobrepeso y obesidad. No era el objetivo del presente estudio investigar esto y los resultados de este estudio no deben utilizarse para evaluar el posible efecto de las papas sobre el riesgo de desarrollar DT2 y ECV debido a su IG alto.
Conclusiones
En conclusión, no se hallaron diferencias significativas en el criterio primario de valoración —la saciedad subjetiva— y en los criterios secundarios de valoración —hambre, plenitud, posible consumo de alimentos o aporte energético a discreción— entre las dos variedades de papa. Esto indica que el IG de la papa no es una variable primordial para evaluar la saciedad en hombres con peso normal.
Contribuciones de los autores Conceptualización: S.S.H.A., J.M.F.H. y A.R.; análisis formal: S.S.H.A, J.M.F.H. y A.R.; recaudación de fondos: A.R.; Investigación, S.S.H.A. y J.M.F.H.; metodología: S.S.H.A., J.M.F.H., T.T.H. y A.R.; administración del proyecto: S.S.H.A, J.M.F.H.y A.R.; recursos: S.S.H.A y J.M.F.H.; supervisación: A.R.; visualización: S.S.H.A y J.M.F.H.; redacción (borrador original) S.S.H.A y J.M.F.H.; redacción (revisión y edición): S.S.H.A, J.M.F.H., T.T.H. y A.R.
Fondos Esta investigación no recibió fondos externos.
Agradecimientos Agrico donó generosamente las papas Carisma® y Arizona que se utilizaron en el experimento. Los autores agradecen al profesor titular Christian Ritz por el aporte estadístico; al profesor asistente Jakob Lund Laugesen por su ayuda con Evascale©; a la coordinadora de prácticas clínicas adecuadas, Le Lene Stevner, por su orientación; a la encargada de la cocina, Charlotte Kostecki, y al resto del personal de cocina por su ayuda. Estas personas son parte del Departamento de Nutrición, Ejercicio y Deporte de la Universidad de Copenhague. Por último, los autores agradecen a los participantes y a Harry Iwema y a Cindy Okkes- van de Wiel de Agrico por su ayuda y asistencia en la provisión de papas.
Conflictos de interés Los autores declaran no tener conflictos de interés.
REFERENCIAS
1. Potato Profile. (2018). Disponible en: https://www. agmrc.org/commodities-products/vegetables/potato-profile (consultada el 20 de julio de 2018).
2. FAOSTAT. (2018). Disponible en: http://www. fao.org/statistics/en/ (consultada el 20 July 2018).
3. Ek, K.L.; Brand-Miller, J.; Copeland, L. (2012). Glycemic effect of potatoes. Food Chem. 2012, 133, 1230–1240. [CrossRef]
4. Drewnowski, A. (2010). The nutrient rich foods index helps to identify healthy foods. Am. J. Clin. Nutr. 2010, 91, 1095–1101. [CrossRef] [PubMed]
5. Camire, M.E.; Kubow, S.; Donelley, D.J. (2009). Potatoes and Human Health. Crit. Rev. Food Sci. Nutr. 2009, 49, 823-840. [CrossRef] [PubMed]
6. Burlingame, B.; Mouillé, B.; Charrondière, R. (2009). Nutrients, bioactive non-nutrients and anti-nutrients in potatoes.
7. J. Food Compos. (2009). Anal. , 22, 494-502. [CrossRef]
7. McGill, C.R.; Kurilich, A.C.; Davignon, J. (2013). The role of potatoes and potato components in cardiometabolic health: A review. Ann. Med. 2013, 45, 467-473. [CrossRef] [PubMed]
8. Anderson, G.H.; Soeandy, C.D.; Smith, C.E. (2013). White Vegetables: Glycemia and Satiety. Adv. Nutr. An Int. Rev. J. 2013, 4, 356S–367S. [CrossRef] [PubMed]
9. Ek, K.L.; Wang, S.; Copeland, L.; Brand-Miller, J.C. (2013). Discovery of a low-glycaemic index potato and relationship with starch digestion in vitro. Br. J. Nutr. 2013, 111, 699-705. [CrossRef] [PubMed]
10. Atkinson, F.S.; Foster-Powell, K.; Brand-Miller, J.C. (2008). International Tables of Glycemic Index and Glycemic Load Values. Diabetes Care 2008, 31, 18–20. [CrossRef] [PubMed]
11. Ludwig, D.S. (2002). The Glycemic Index. J. Am. Med. Assoc. 2002, 287, 2414-2423. [CrossRef]
12. Brand-Miller, J.; Dickinson, S.; Barclay, A.; Celermajer, D. (2007). The glycemic index and cardiovascular disease risk. Curr. Atheroscler. Rep. 2007, 9, 479–485. [CrossRef] [PubMed]
13. Willett, W.; Manson, J.; Liu, S. (2002). Glycemic index, glycemic load, and risk of type 2 diabetes. Am. J. Clin. Nutr. 2002, 76, 274–280. [CrossRef]
14. Brand-miller, J.C.; Holt, S.H.A.; Pawlak, D.B.; Mcmillan, J. (2002). Glycemic index and obesity. Am. J. Clin. Nutr. 2002, 76, 281-285. [CrossRef]
15. Jenkins, D.J.A.; Wolever, T.M.S.; Taylor, R.H.; Barker, H.; Fielden, H.; Baldwin, J.M.; Bowling, A.C.; Newman, H.C.; Jenkins, A.L.; Goff, D.V. (1981). Glycemic index of foods: A physiological basis for carbohydrate exchange. Am. J. Clin. Nutr. 1981, 34, 362-366. [CrossRef] [PubMed]
16. Pawlak, D.; Ebbeling, C.B.; Ludwig, D. (2002). Should obese patients be counselled to follow a low- glycaemic index diet? Yes. Obes. Rev. 2002, 3, 235–243. [CrossRef] [PubMed]
17. ISO Standard 26642:2010 (2010). Food products–Determination of the glycaemic index (GI) and recommendation for food classification. Disponible en: https://www.iso.org/standard/43633.html (accessed on 20 July 2018).
18. Foster-Powell, K.; Holt, S.; Brand-Miller, J. (2002). International table of glycemic index and glycemic load values: 2002. Am. Soc. Clin. Nutr. 2002, 76, 5-56. [CrossRef] [PubMed]
19. Levin, B.E. (2006). Metabolic sensing neurons and the control of energy homeostasis. Physiol. Behav. 2006, 89, 486-489. [CrossRef] [PubMed]
20. Jordan, S.D.; Könner, A.C.; Brüning, J.C. (2010). Sensing the fuels: Glucose and lipid signaling in the CNS controlling energy homeostasis. Cell. Mol. Life Sci. 2010, 67, 3255-3273. [CrossRef] [PubMed]
21. Marks, J.L.; Porte, D.; Stahl, W.L.; Baskin, D.G. (1990). Localization of insulin receptor mRNA in rat brain by in situ hybridization. Endocrinology 1990, 127, 3234–3236. [CrossRef] [PubMed]
22. Bornet, F.R.J.; Jardy-Gennetier, A.E.; Jacquet, N.; Stowell, J. (2007). Glycaemic response to foods: Impact on satiety and long-term weight regulation. Appetite 2007, 49, 535–553. [CrossRef] [PubMed]
23. Anderson, G.H.; Catherine, N.L.A.; Woodend, D.M.; Wolever, T.M.S. (2002). Inverse association between the effect of carbohydrates on blood glucose and subsequent short-term food intake in young men. Am. J. Clin. Nutr. 2002, 76, 1023-1030. [CrossRef] [PubMed]
24. Leeman, M.; Oestman, E.; Bjoerck, I. (2008). Glycaemic and satiating properties of potato products. Eur. J. Clin. Nutr. 2008, 62, 87-95. [CrossRef] [PubMed]
25. Geliebter, A.; Lee, M.I.C.; Abdillahi, M.; Jones, J. (2013). Satiety following intake of potatoes and other carbohydrate test meals. Ann. Nutr. Metab. 2013, 62, 37-43. [CrossRef] [PubMed]
26. Agrico 2018. (2018). Okkes-van de Wiel, C. ; [email protected]; Iwema, H.; [email protected]. (email communication)
27. Eurofins, S.L.A. (2018). Disponible en: https://www. eurofins.dk/foedevarer/ (accessed on 1 February 2018).
28. Klingenberg, L.; Nyby, S.; Kristensen, M.B.; Raben, A. (2015). Visual analogue scales to assess appetite sensation- good agreement between 100 mm pen and paper vs tablet-based scores. Obes. Facts. 2015, 8, 101.
29. Evascale©. Laugesen, J. L. (2017). jalul@food. ku.dk. (email communication)
30. Flint, A.; Raben, A.; Blundell, J.; Astrup, A. (2000). Reproducibility, power and validity of visual analogue scales in assessment of appetite sensations in single test meal studies. Int. J. Obes. 2000, 24, 38–48. [CrossRef]
31. Gregersen, N.T.; Flint, A.; Bitz, C.; Blundell, J.E.; Raben, A.; Astrup, A. (2008). Reproducibility and power of ad libitum energy intake assessed by repeated single meals. Am. J. Clin. Nutr. 2008, 87, 1277–1281. [CrossRef] [PubMed]
32. Kirkmeyer, S.V.; Mattes, R.D. (2000). Effects of food attributes on hunger and food intake. Int. J. Obes. Relat. Metab. Disord. 2000, 24, 1167–1175. [CrossRef] [PubMed]
33. Kral, T.V.; Roe, L.S.; Rolls, B.J. (2004). Combined effects of energy density and portion size on energy intake in women. Am. Soc. Clin. Nutr. 2004, 79, 962–968. [CrossRef] [PubMed]
34. Holt, S.; Brand-Miller, J.; Petocz, P. (1995). Farmakalidis E A satiety index of common foods. Eur. J. Clin. Nutr. 1995, 49, 675690. [CrossRef]
35. Sacks, F.M.; Carey, V.J.; Anderson, C.A.M.; Miller, E.R.; Copeland, T.; Charleston, J.; Harshfield, B.J.; Laranjo, N.; McCarron, P.; Swain, J.; et al. (2014). Effects of High vs. Low Glycemic Index of Dietary Carbohydrate on Cardiovascular Disease Risk Factors and Insulin Sensitivity. Jama 2014, 312, 2531–2541. [CrossRef] [PubMed]
36. Maljaars, J.; Peters, H.P.F.; Masclee, A.M. (2007). Review article: The gastrointestinal tract: Neuroendocrine regulation of satiety and food intake. Aliment. Pharmacol. Ther. 2007, 26, 241–250. [CrossRef] [PubMed]
37. Blundell, J.E.; Tremblay, A. (1995). APPETITE CONTROL AND ENERGY (FUEL) BALANCE. Nutr. Res. Rev. 1995, 8, 225–242. [CrossRef] [PubMed]
38. De Graaf, C.; Blom, W.A.M.; Smeets, P.A.M.; Stafleu, A.; Hendriks, H.F.J. (2004). Biomarkers of satiation and satiety Am. J. Clin. Nutr. 2004, 79(, 946–961. [CrossRef] [PubMed].
39. Erdmann, J.; Hebeisen, Y.; Lippl, F.; Wagenpfeil, S.; Schusdziarra, V. (2007). Food intake and plasma ghrelin response during potato-, rice- and pasta-rich test meals. Eur. J. Nutr. 2007, 46, 196–203. [CrossRef] [PubMed]
40. Akilen, R.; Deljoomanesh, N.; Hunschede, S.; Smith, C.E.; Arshad, M.U.; Kubant, R.; Anderson, G.H.; Lamont, B.J.; Waters, M.F.; Andrikopoulos, S. (2016). The effects of potatoes and other carbohydrate side dishes consumed with meat on food intake, glycemia and satiety response in children. Nutr. Diabetes 2016, 6. [CrossRef] [PubMed]
41. Holt, S.H.A.; Brand-Miller, J.C.; Stitt, P.A. (2001). The effects of equal-energy portions of different breads on blood glucose levels, feelings of fullness and subsequent food intake. J. Am. Diet. Assoc. 2001, 101, 767–773. [CrossRef]
42. Holt, S.H.; Brand Miller, J.C.; Petocz, P. (1996). Interrelationships among postprandial satiety, glucose and insulin responses and changes in subsequent food intake. Eur. J. Clin. Nutr. 1996, 50, 788–797. [PubMed]
43. Warren, J.M.; Henry, C.J.K.; Simonite, V. (2003). Low Glycemic Index Breakfasts and Reduced Food Intake in Preadolescent Children. Pediatrics 2003, 112, 414–419. [CrossRef]
44. Ball, S.D.; Keller, K.R.; Moyer-Mileur, L.J.; Ding, Y.-W.; Donaldson, D.; Jackson, W.D. (2003). Prolongation of Satiety After Low Versus Moderately High Glycemic Index Meals in Obese Adolescents. Pediatrics 2003, 111, 488–494. [CrossRef] [PubMed]
45. Esfahani, A.; Wong, J.M.W.; Mirrahimi, A.; Villa, C.R.; Kendall, C.W.C. (2011). The application of the glycemic index and glycemic load in weight loss: A review of the clinical evidence. IUBMB Life 2011, 63, 7–13. [CrossRef] [PubMed]
46. Aston, L.M.; Stokes, C.S.; Jebb, S.A. (2007). No effect of a diet with a reduced glycaemic index on satiety, energy intake and body weight in overweight and obese women. Int. J. Obes. 2007, 32, 160–165. [CrossRef] [PubMed]
47. Sloth, B.; Krog-Mikkelsen, I.; Flint, A.; Tetens, I.; Bjorck, I.; Vinoy, S.; Elmstahl, H.; Astrup, A.; Lang, V.; Raben, A. (2004). No difference in body weight decrease between a low- glycemic- index and a high- glycemic- index diet but reduced LDL cholesterol after 10-wk ad libitum intake of the low- glycemic- index diet. Am. J. Clin. Nutr. 2004, 80, 337–347. [CrossRef] [PubMed]
48. Krog-Mikkelsen, I.; Sloth, B.; Dimitrov, D.; Tetens, I.; Bjorck, I.; Flint, A.; Holst, J.J.; Astrup, A.; Elmstahl, H.; Raben, A. (2011). A Low Glycemic Index Diet Does Not Affect Postprandial Energy Metabolism but Decreases Postprandial Insulinemia and Increases Fullness Ratings in Healthy Women. J. Nutr. 2011, 141, 1679–1684. [CrossRef] [PubMed]
49. Flint, A.; Møller, B.K.; Raben, A.; Sloth, B.; Pedersen, D.; Tetens, I.; Holst, J.J.; Astrup, A. (2006). Glycemic and insulinemic responses as determinants of appetite in humans. Am. J. Clin. Nutr. 2006, 84, 1365–1373. [CrossRef] [PubMed]
50. Flint, A.; Gregersen, N.T.; Gluud, L.L.; Møller, B.K.; Raben, A.; Tetens, I.; Verdich, C.; Astrup, A. (2007). Associations between postprandial insulin and blood glucose responses, appetite sensations and energy intake in normal weight and overweight individuals: A meta-analysis of test meal studies. Br. J. Nutr. 2007, 98, 17–25. [CrossRef] [PubMed]
51. Feinle, C.; Christen, M.; Grundy, D.; Faas, H.; Meier, O.; Otto, B.; Fried, M. (2002). Effects of duodenal fat, protein or mixed-nutrient infusions on epigastric sensations during sustained gastric distension in healthy humans. Neurogastroenterol. Motil. 2002, 14, 205–213. [CrossRef] [PubMed]
52. Nakajima, S.; Hira, T.; Tsubata, M.; Takagaki, K.; Hara, H. (2011). Potato extract (Potein) suppresses food intake in rats through inhibition of luminal trypsin activity and direct stimulation of cholecystokinin secretion from enteroendocrine cells. J. Agric. Food Chem. 2011, 59, 9491–9496. [CrossRef] [PubMed]
53. Vega-López, S.; Ausman, L.M.; Griffith, J.L.; Lichtenstein, A.H. (2007). Interindividual variability and intra-individual reproducibility of glycemic index values for commercial white bread. Diabetes Care 2007, 30, 1412–1417. [CrossRef] [PubMed]
54. Wolever, T.M.; Jenkins, D.J. (1986). The use of the glycemic index in predicting the blood glucose response to mixed meals. Am. J. Clin. Nutr. 1986, 43, 167-172. [CrossRef] [PubMed]
55. Dodd, H.; Williams, S.; Brown, R.; Venn, B. (2011). Calculating meal glycemic index by using measured and published food values compared with directly measured meal glycemic index. Am. J. Clin. Nutr. 2011, 94, 992–996. [CrossRef] [PubMed]
56. Flint, A.; Møller, B.K.; Raben, A.; Pedersen, D.; Testens, I.; Holst, J.J.; Astrup, A. (2004). The use of glycaemic index tables to predict glycaemic index of breakfast meals. Br. J. Nutr. 2004, 91, 979–989. [CrossRef] [PubMed]
57. Anderson, G.H.; Tecimer, S.N.; Shah, D.; Zafar, T.A. (2004). Protein source, quantity, and time of consumption determine the effect of proteins on short-term food intake in young men. Am. Soc. Nutr. Sci. 2004, 134, 3011–3015. [CrossRef] [PubMed]
58. Camps, G.; Mars, M.; De Graaf, C.; Smeets, P.A.M. (2016). Empty calories and phantom fullness: A randomized trial studying the relative effects of energy density and viscosity on gastric emptying determined by MRI and satiety. Am. J. Clin. Nutr. 2016, 104, 73–80. [CrossRef] [PubMed]
59. Raben, A.; Tagliabue, A.; Christensen, N.J.; Holst, J.J.; Astrup, A. (1994). Resistant starch: The effect on prostprandial glycemia, hormonal respose and satiety. Am. J. Clin. Nutr. 1994, 60, 544–551. [CrossRef] [PubMed]
60. Barr, S.I.; Janelle, K.C.; Prior, J.C. (1995). Energy intakes are higher during the luteal phase of ovulatory menstrual cycles. Am. J. Clin. Nutr. 1995, 61, 39–43. [CrossRef] [PubMed]
61. Hjorth, M.F.; Ritz, C.; Blaak, E.E.; Saris, W.H.; Langin, D.; Poulsen, S.K.; Larsen, T.M.; Sørensen, T.I.; Zohar, Y.; Astrup, A. (2017). Pretreatment fasting plasma glucose and insulin modify dietary weight loss success: Results from 3 randomized clinical trials. Am. J. Clin. Nutr. 2017, 106, 499–505. [CrossRef] [PubMed]
62. Hjorth, M.F.; Due, A.; Larsen, T.M.; Astrup, A. (2017). Pretreatment Fasting Plasma Glucose Modifies Dietary Weight Loss Maintenance Success: Results from a Stratified RCT. Obesity 2017, 25, 2045–2048. [CrossRef] [PubMed]
63. Blaak, E.E.; Antoine, J.M.; Benton, D.; Björck, I.; Bozzetto, L.; Brouns, F.; Diamant, M.; Dye, L.; Hulshof, T.; Holst, J.J.; et al. (2012). Impact of postprandial glycaemia on health and prevention of disease. Obes. Rev. 2012, 13, 923-984. [CrossRef] [PubMed]
Efecto agudo del ejercicio de resistencia de baja carga con restricción del flujo sanguíneo sobre los biomarcadores de estrés oxidativo: una revisión sistemática y un metanálisis
Resumen Fondo El propósito de esta revisión fue analizar los efectos agudos del ejercicio de...

Efectos del entrenamiento de swing con pesas rusas sobre la demanda cardiorrespiratoria y metabólica en una competición simulada en jóvenes gimnastas artísticas
ResumenExaminamos los efectos de agregar un programa de entrenamiento de Kettlebell Swing (KB) al...
Efectos y limitaciones del ejercicio de control motor en el hogar para el dolor lumbar crónico: un estudio prospectivo de un solo centro
Resumen Diseño del estudio Estudio observacional prospectivo unicéntrico. Objetivo Investigar los...
Eficacia del entrenamiento de los músculos inspiratorios domiciliario en pacientes post-covid-19: protocolo para un ensayo clínico aleatorizado
Resumen Introducción La evidencia actual sugiere la aparición de un nuevo síndrome (síndrome de...

Estimación de la carga relativa a partir de la velocidad del movimiento en el ejercicio de press de pecho sentado en adultos mayores
Resumen Apuntar Este estudio tuvo como objetivo i) determinar la relación carga-velocidad en el...