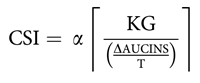Artículo publicado en el journal PubliCE del año 2017.
Publicado 11 de agosto de 2017
Resumen
Objetivo
Nosotros investigamos si el entrenamiento interválico de sprint (SIT) era una estrategia de ejercicio tiempo-eficaz para mejorar la sensibilidad de la insulina y otros índices de la salud cardiometabólica a la misma magnitud como el entrenamiento contínuo tradicional de moderada intensidad (MICT). El SIT implicaba 1 minuto de ejercicio intenso dentro de un compromiso de tiempo de 10 minutos, mientras que el MICT involucraba 50 minutos de ejercicio continuo por sesión.
Métodos
Hombres sedentarios (27±8 años; BMI = 26±6 kg/m2) realizaron tres sesiones semanales de SIT (n = 9) o de MICT (n = 10) durante 12 semanas o sirvieron como controles sin entrenamiento (n = 6). El SIT consistía de sprints 3×20-segundos ‘extremo’ en cicloergómetro (~500W) entremezclados con 2 minutos de pedaleo a 50W, mientras que el MICT consistió de 45 minutos de pedaleo continuo al ~70% de la frecuencia cardíaca máxima (~110W). Ambos protocolos involucraban una entrada en calor de 2 minutos y 3 minutos de vuelta a la calma a 50W.
Resultados
Peak oxygen uptake increased after training by 19% in both groups (SIT: 32±7 to 38±8; MICT: 34±6 to 40±8ml/kg/min; p<0.001 for both). Insulin sensitivity index (CSI), determined by intravenous glucose tolerance tests performed before and 72 hours after training, increased similarly after SIT (4.9±2.5 to 7.5±4.7, p = 0.002) and MICT (5.0±3.3 to 6.7±5.0 x 10−4 min-1 [μU/mL]-1, p = 0.013) (p<0.05). Skeletal muscle mitochondrial content also increased similarly after SIT and MICT, as primarily reflected by the maximal activity of citrate synthase (CS; P<0.001). The corresponding changes in the control group were small for VO2peak (p = 0.99), CSI (p = 0.63) and CS (p = 0.97).
El consumo de oxígeno pico aumentó después del entrenamiento por 19% en ambos grupos (SIT: 32±7 a 38±8; MICT: 34±6 a 40±8 ml/kg/min; p <0.001 para ambos). El índice de sensibilidad de Insulina (CSI), determinado por tests de tolerancia a la glucosa intravenosos realizados antes y 72 horas después del entrenamiento, aumentó similarmente después de SIT (4.9±2.5 a 7.5±4.7, p = 0.002) y de MICT (5.0±3.3 a 6.7±5.0 x 10-4 min-1 [μU/mL]-1, p = 0.013) (p <0.05). El contenido mitocondrial del músculo esquelético también aumentó similarmente después de SIT y MICT, como principalmente fue reflejado por la mayor actividad de la citrato sintetasa (CS; P <0.001). Los cambios correspondientes en el grupo de control fueron pequeños para el VO2pico (p = 0.99), CSI (p = 0.63) y CS (p = 0.97).
Conclusiones
Doce semanas de ejercicio breve de intervalos intensos mejoraron índices de salud cardiometabólica en la misma magnitud como el entrenamiento de la resistencia tradicional en hombres sedentarios, a pesar de un volumen de ejercicio y compromiso de tiempo inferior cinco veces
Cita: Gillen JB, Martin BJ, MacInnis MJ, Skelly LE, Tarnopolsky MA, Gibala MJ (2016) Twelve Weeks of Sprint Interval Training Improves Indices of Cardiometabolic Health Similar to Traditional Endurance Training despite a Five-Fold Lower Exercise Volume and Time Commitment. PLoS ONE 11(4): e0154075. doi:10.1371/journal.pone.0154075
Editor: Øyvind Sandbakk, Norwegian University of Science and Technology, NORWAY
Recibido: Diciembre 16, 2015; Aceptado: Abril 8, 2016; Publicado: Abril 26, 2016
Copyright: © 2016 Gillen et al.
Resumen
Objetivo
Nosotros investigamos si el entrenamiento interválico de sprint (SIT) era una estrategia de ejercicio tiempo-eficaz para mejorar la sensibilidad de la insulina y otros índices de la salud cardiometabólica a la misma magnitud como el entrenamiento contínuo tradicional de moderada intensidad (MICT). El SIT implicaba 1 minuto de ejercicio intenso dentro de un compromiso de tiempo de 10 minutos, mientras que el MICT involucraba 50 minutos de ejercicio continuo por sesión.
Métodos
Hombres sedentarios (27±8 años; BMI = 26±6 kg/m2) realizaron tres sesiones semanales de SIT (n = 9) o de MICT (n = 10) durante 12 semanas o sirvieron como controles sin entrenamiento (n = 6). El SIT consistía de sprints 3×20-segundos ‘extremo’ en cicloergómetro (~500W) entremezclados con 2 minutos de pedaleo a 50W, mientras que el MICT consistió de 45 minutos de pedaleo continuo al ~70% de la frecuencia cardíaca máxima (~110W). Ambos protocolos involucraban una entrada en calor de 2 minutos y 3 minutos de vuelta a la calma a 50W.
Resultados
Peak oxygen uptake increased after training by 19% in both groups (SIT: 32±7 to 38±8; MICT: 34±6 to 40±8ml/kg/min; p<0.001 for both). Insulin sensitivity index (CSI), determined by intravenous glucose tolerance tests performed before and 72 hours after training, increased similarly after SIT (4.9±2.5 to 7.5±4.7, p = 0.002) and MICT (5.0±3.3 to 6.7±5.0 x 10−4 min-1 [μU/mL]-1, p = 0.013) (p<0.05). Skeletal muscle mitochondrial content also increased similarly after SIT and MICT, as primarily reflected by the maximal activity of citrate synthase (CS; P<0.001). The corresponding changes in the control group were small for VO2peak (p = 0.99), CSI (p = 0.63) and CS (p = 0.97).
El consumo de oxígeno pico aumentó después del entrenamiento por 19% en ambos grupos (SIT: 32±7 a 38±8; MICT: 34±6 a 40±8 ml/kg/min; p <0.001 para ambos). El índice de sensibilidad de Insulina (CSI), determinado por tests de tolerancia a la glucosa intravenosos realizados antes y 72 horas después del entrenamiento, aumentó similarmente después de SIT (4.9±2.5 a 7.5±4.7, p = 0.002) y de MICT (5.0±3.3 a 6.7±5.0 x 10-4 min-1 [μU/mL]-1, p = 0.013) (p <0.05). El contenido mitocondrial del músculo esquelético también aumentó similarmente después de SIT y MICT, como principalmente fue reflejado por la mayor actividad de la citrato sintetasa (CS; P <0.001). Los cambios correspondientes en el grupo de control fueron pequeños para el VO2pico (p = 0.99), CSI (p = 0.63) y CS (p = 0.97).
Conclusiones
Doce semanas de ejercicio breve de intervalos intensos mejoraron índices de salud cardiometabólica en la misma magnitud como el entrenamiento de la resistencia tradicional en hombres sedentarios, a pesar de un volumen de ejercicio y compromiso de tiempo inferior cinco veces
Cita: Gillen JB, Martin BJ, MacInnis MJ, Skelly LE, Tarnopolsky MA, Gibala MJ (2016) Twelve Weeks of Sprint Interval Training Improves Indices of Cardiometabolic Health Similar to Traditional Endurance Training despite a Five-Fold Lower Exercise Volume and Time Commitment. PLoS ONE 11(4): e0154075. doi:10.1371/journal.pone.0154075
Editor: Øyvind Sandbakk, Norwegian University of Science and Technology, NORWAY
Recibido: Diciembre 16, 2015; Aceptado: Abril 8, 2016; Publicado: Abril 26, 2016
Copyright: © 2016 Gillen et al.
INTRODUCCIÓN
El entrenamiento físico regular está bien aceptado como una intervención terapéutica eficaz para la prevención y tratamiento de muchas enfermedades crónicas, incluso la diabetes tipo 2 [1,2]. El entrenamiento físico de resistencia mejora el fitness cardiorespiratorio [3], induce el remodelamiento del músculo esquelético hacia un fenotipo más oxidativo [4] y promueve cambios favorables en la sensibilidad de la insulina [1]. Estos beneficios bien establecidos en la salud bien dan apoyo para pautas actuales de la actividad física que recomiendan 150 minutos de actividad física aeróbica de moderada intensidad o 75 minutos de vigorosa intensidad por semana [5-7]. A pesar de la asociación entre las bajas cantidades de actividad física y mayor riesgo de muchas enfermedades crónicas, el predominio de la inactividad física es superior que el de todos los otros factores de riesgo modificables [2]. Las razones para no someterse en una actividad física regular son numerosas y complejas, pero la "falta de tiempo" es unao de las barreras normalmente citadas [8]. Por lo tanto, desarrollar estrategias de ejercicio físico más tiempo-eficaces, se igualmente efectivas, son necesarias en forma urgente.
En contraste al entrenamiento de la resistencia tradicional, el entrenamiento interválico de sprint (SIT) se caracteriza por turnos intermitentes breves de ejercicio relativamente intenso separados por períodos de ejercicio de baja intensidad durante la recuperación [9]. Un modelo SIT normalmente estudiado es el Wingate Test repetido; típicamente, se realizan cuatro a seis turnos de 30 segundos de pedaleo "extremo" por sesión, entremezclados por 4 minutos de recuperación. Estudios que han comparado directamente varias semanas de Wingate basados en SIT a un entrenamiento continuo de moderada intensidad (MICT), han reportado mejoras similares en el fitness cardiorespiratorio [10], capacidad oxidativa del músculo esquelético [10,11] y sensibilidad a la insulina en base a test oral de tolerancia a la glucosa [12,13].
Dado que el SIT basado en Wingate involucra ~20-30 minutos por sesión, sin incluir la entrada en calor o vuelta a la calma, la "eficiencia de tiempo" pretendida de este tipo de entrenamiento ha sido cuestionada [14]. Recientes estudios han demostrado que los protocolos de SIT muy breves que involucran ?10 minutos por sesión provocan adaptaciones similares a los protocolos más largos de SIT y de MICT [15-17].
Por ejemplo, un protocolo de pedaleo que involucra tres sprints ‘extremo’ de 20 segundos, dentro de una sesión de entrenamiento de ≤10 minutos incluyendo la entrada en calor y vuelta a la calma, el fitness cardiorespiratorio mejoraba y la concentración de la glucosa sanguínea promedio de 24 horas se reducía en adultos con sobrepeso cuando era realizado tres veces por semana durante 6 semanas [17]. Ningún estudio ha comparado este tipo de protocolo de SIT muy breve directamente al entrenamiento de la resistencia tradicional, ni midió cambios en el control glucémico usando una medida robusta de la sensibilidad de la insulina.
El propósito de este estudio fue comparar los efectos de 12 semanas de SIT o MICT sobre la sensibilidad de la insulina y otro índices de salud cardiometabólica que incluyen el fitness cardiorespiratorio y el contenido mitocondrial del músculoesquelético en hombres sedentarios. Los dos protocolos diferían notablemente con respecto al volumen del ejercicio total y al compromiso de tiempo: el SIT involucró 1 minuto de ejercicio intermitente intenso dentro de una sesión de 10 minutos, mientras que el MICT consistió en 50 minutos de ejercicio contínuo de moderada intensidad. Nosotros supusimos que comparado a un grupo de control sin entrenamiento (CTL), el SIT y el MICT aumentarían la sensibilidad de la insulina similarmente en base al método del test de tolerancia a la glucosa intravenosa, el fitness cardiorespiratorio determinado por un test de consumo de oxígeno pico (VO2pico) y el contenido mitocondrial reflejado por la actividad máxima de citrato sintetasa.
MÉTODOS
Sujetos y aprobación ética
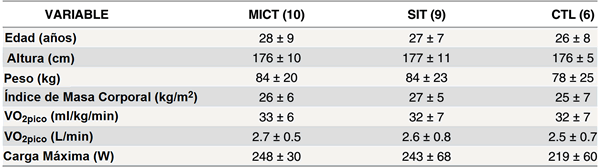
Veintisiete hombres sedentarios tomaron parte en el estudio. Generalmente los participantes son juzgados como inactivos en base a una registro de la Encuesta de Actividad Fsica Internacional (PAQ) de menos de 600 METS-minutos por semana. Se emparejaron los participantes por edad, BMI y VO2pico, y fueron asignados a SIT, MICT o CTL. Un sujeto en cada uno de los dos grupos de entrenamiento dejaron el estudio por razones no relacionadas a los protocolos, resultando en n = 9, 10 y 6 en SIT, MICT y CTL, respectivamente (Tabla 1). El protocolo experimental fue aceptado por la Junta de Ética de Investigación Integradade Hamilton. A todos los participantes se les dio el consentimiento informado por escrito.
Tabla 1. Características de los sujetos.
Los valores son promedios ±SD. VO2pico, consumo de oxígeno pico. Ninguna diferencia se observó entre los grupos en los valores de inicio para cualquier variable.
PROTOCOLO EXPERIMENTAL
Evaluación inicial y familiarización del ejercicio.
Los participantes realizaron un test de VO2pico incremental en un cicloergómetro con carga electrónica (Lode Excalibur Sport V 2.0, Países Bajos), como fue descrito previamente [17]. Brevemente, después de una entrada en calor de 1 minuto a 50 W, la resistencia era aumentada por 1 W cada 2 segundos hasta el agotamiento o cuando la cadencia de pedaleo caía por debajo de 50 rpm. Para todos los tests un RER >1.1 fue alcanzado. Los datos del consumo de oxígeno y de la producción de dióxido de carbono eran adquiridos a través de una carreta metabólica con un sistema de recolección de gases en línea (Moxus, AEI Technologies, PA), y el VO2pico fue definido como el consumo de oxígeno promedio más alto sobre 30 segundos.
Aproximadamente 5 días después y después de un ayuno durante la noche de 10 horas, los participantes fueron sometido a un test de composición corporal y un test de tolerancia a la glucosa intravenoso de 50 minutos (IVGTT). Los participantes consumieron una comida estandarizada la noche antes de la visita consistente en 561±99kcal (47±2% carbohidratos, 31±3% grasas y 22±4% proteínas). La masa grasa fue determinada a través de de una pletismografía de desplazamiento de aire (BodPod®,COSMED). Como consecuencia, una enfermera entrenada insertó dos catéteres en las venas del antebrazo (uno en cada brazo). Una muestra de sangre del ayuno (12ml) se obtuvo del "brazo de muestra", y la glucosa (0.5g/kg hasta 35g) se liberaba manualmente al "brazo de infusión" contralateral durante 3 minutos. Una solución con 38±2% de glucosa (Hospira LifeCare) fueusado en un volumen total de 90ml. Muestras de sangre (8ml) fueron obtenidas del "brazo de muestra" cada 10 minutos durante 50 minutos post-infusión. El plasma y el suero fueron separados por centrifugación y guardados a -80°C.
Aproximadamente 2 días después, una biopsia muscular de reposo del vasto externo (~100mg) fue obtenido usando la aguja de Bergström adaptada con succión, como está descrito previamente [18]. Brevemente, una única muestra muscular (~100 mg) se obtuvo del vasto externo bajo anestesia local (1% de lidocaína) usando una aguja de Bergström adaptada con succión. Las muestras fueron seccionadas en varias piezas en cápsulas heladas en nitrógeno líquido y guardadas a -80°C para un análisis más tarde.
Al menos 5 días después de la biopsia muscular, la familiarización del ejercicio tuvo lugar. Los participantes en SIT realizaron dos sprints ‘extremo’ de 20 segundos en un cicloergómetro electrónico (Veletron, RacerMate, EE.UU.). Los participantes en el MICT estaban con un monitor de frecuencia cardíaca (FC) (Polar A3, Lake Success, EE.UU.) y pedalearon en un cicloergómetro (Kettler, Ergo Race I, Alemania) durante ~20 minutos para determinar la carga de trabajo que provocaba el 64-76% de la frecuencia cardíaca máxima (FCmáx). La FC designada para el MICT era en base a la clasificación para ser de "moderada intensidad" propuesta por el American College of Sports Medicine [6].
Intervención de entrenamiento de 12 semanas.
El entrenamiento consistía de una fase de entrada, en cual una sesión se completaba en la semana 1, y dos sesiones en la semana 2. El ejercicio se realizó tres veces por semana después de eso, con la excepción de la semana 7 donde se reemplazaban dos sesiones con una evaluación de mitad del entrenamiento para el VO2pico e imagen de ultrasonido arterial (una medida colaborativa no reportada en el estudio presente). Durante el entrenamiento, un monitor de FC registaba cada 5 segundos la FC, a partir de la cual, lla FC promedio durante cada sesión era determinada. El protocolo de SIT consistió en sprints 3×20 segundos ‘extremo’ contra 0.05kg/kg del peso corporal, separados por 2 minutos de pedaleo de baja intensidad (50W)..
Post-evaluación.
Los participantes repitieron el test de composición corporal y el IVGTT 72 horas después de terminar el entrenamiento. Una biopsia muscular de reposo se obtuvo 24 horas después, o 96 horas post-entrenamiento. Un test de VO2pico se realizó aproximadamente 4 días después de la biopsia y 1 semana después del entrenamiento. Todos los procedimientos efueron idénticos a la evaluación inicial..
Pruebas de glucosa e insulina.
La glucosa en plasma fue analizada (Pointe Scientific, EE.UU.), y la insulina en suero fue medida con el método ELISA (ALPCO Immunoassays, EE.UU.). El índice de sensibilidad de la insulina (CSI) a partir de un IVGTT de 50 minutos fue calculado como fue propuesto por Tura y cols. [19]. El CSI está muy correlacionado con el modelo mínimo de Índice de sensibilidad a la insulina (SI) obtenido a partir de un IVGTT de 3 horas, así como la tasa de infusión de glucosa durante un ‘clamp’ hiperinsulinemia-euglicémico [19]. Este método también se ha usado para evaluar la sensibilidad de la insulina en respuesta al ejercicio agudo [20,21], y tiene una reproductibilidad mayor que el índice de Matsuda compuesto (MISI) derivado de un OGTT [20]. Brevemente, el CSI fue calculado como sigue:
dónde α un factor de escala es (0.604), KG es la tasa de desaparición de glucosa (mol/L; calculado como la cuurva de logaritmo [glucosa]) ΔAUCINS el área de insulina bajo la curva por encima de basal (uIU/ml) y T el tiempo es entre 10 y 50 minutos (40 minutos) desde el cual KG y ΔAUCINS sean calculado [19].
La Delta de glucosa y el área de insulina bajo la curva (AUC) de 0-50 minutos también fueron calculados, y la resistencia de insulina en ayuno fue determinado por HOMA-IR [22].
Análisis muscular.
Para la actividad enzimática, un trozo de músculo (~25mg) se homogeneizó como está descrito previamente [17]. Las actividades máximas de la citrato sintetasa (CS) y 3-β-hidroxiacil deshidrogenasa CoA (β-HAD) fueron determinadas usando técnicas establecidas [23]. Las muestras reproducidas y el coeficiente de variación intra-ensayo para los CS y β-HAD eran 3.0 y 6.5%, respectivamente. La concentración de proteínas fue determinada (BCA Protein Assay, Pierce, EE.UU.) y la actividad de las enzimas se expresa como mmol/kg proteina/hora.
For western blotting, a piece of muscle (~30mg) was homogenized in RIPA buffer as previously described [17] and western blot analysis was conducted using established techniques [17,24]. ImageJ software was used to quantify the optical density of protein bands. α-tubulin (Cell Signaling Technology, #2125), which did not change following training (p = 0.85), was used as a loading control. The following primary antibodies from Mitosciences were used: NDUFA9 (MS111), CII-70 kDa subunit (MS204), CIII-Core protein 2 (MS304), CIV subunit IV (MS408), ATP synthase α-subunit (MS507) and GLUT4 (Millipore, AB1345).
Por secado con papel secante, un trozo de músculo (~30mg) fue homogeneizado previamente en el ‘buffer’ RIPA como fue descrito [17] y el análisis del secado usó técnicas establecidas [17,24]. El software ImageJ fue usado para cuantificar la densidad óptica de las bandas de proteína. α- tubulina (Cell Signaling Technology#2125) que no cambió luego del entrenamiento (p = 0.85), fue usada como un control de carga. Los siguientes anticuerpos primarios de Mitosciences fueron utilizados: NDUFA9 (MS111), CII-70 kDa subunidad (MS204), CIII-core proteín 2 (MS304), subunidad de CIV IV (MS408), ATP sintetasa α-subunidad (MS507) y GLUT4 (Millipore, AB1345).
Estadística.
Las características iniciales (Tabla 1) se analizaron usando un análisis de variación (ANOVA) de sentido único (grupo)l. Los datos musculares, de la sangre, del VO2pico y de la composición corporal fueron analizados usando un ANOVA bidireccional con el el facto inter-grupo (niveles: SIT, MICT, CTL) y factor intra-tiempo (niveles: pre- y post-entrenamiento para todas las variables salvo el VO2pico que también incluyó un punto de tiempo de mitad del entrenamiento). Las interacciones significativas de tiempo x grupo (p <0.05) se analizaron usando el test post hoc de la diferencia real significativa de un Tukey. Todos los análisis usaron el software SPSS, y la significancia fue fijada en p <0.05. Los datos son presentados como promedios ±SD para n = 10 (MICT), n = 9 (SIT) y n = 6 (CTL). Debido a las dificultades durante la recolección de los datos, nosotros reportamos n = 9 (MICT) y n = 5 (CTL) para los datos de la composición corporal y n = 8 (SIT) para los análisis de sangre.
RESULTADOS
Características descriptivas del entrenamiento
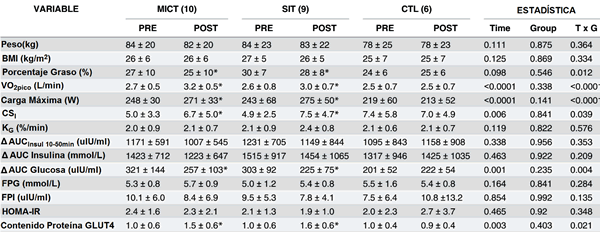
Un total de 31±1 y 32±2 sesiones se completaron en SIT y MICT, respectivamente. La FC media, promediada a lo largo de todas las sesiones de entrenamiento, fue del 79±4% y 71±5% de la FCmáx para SIT y MICT, respectivamente. La RPE media, medido durante las sesiones 1, 15 y 30 del ejercicio, fue de 16±1 para el SIT y de 13±1 para el MICT. El trabajo total promedio fue de ~60 y ~310kJ por sesión para el SITy el MICT, respectivamente. La masa corporal permaneció similar en el transcurso del estudio en todos los grupos. El porcentaje de grasa corporal disminuyó después de SIT (p = 0.011) y de MICT (p = 0.011) mientras que hubo un cambio pequeño en CON (p = 0.12) (Tabla 2). Los registros de cambio con intervalos de confianza del 95%, están disponibles en un archivo suplementario para todos los resultados inducidos por el entrenamiento resumidos en la Tabla 2 (S1 Fig).
Tabla 2. Características descriptivas y marcadores del control glucémico.
Los valores son promedios ±SD. VO2pico, consumo de oxígeno pico; CSI, índice de sensibilidad de la insulina a partir de IVGTT; KG, tasa de desaparición de glucosa durante 10–50 min de IVGTT; ∆ AUCINSUL, área de insulina bajo la curva de 10–50 min de IVGTT; ∆ AUC de insulina, área de insulina bajo la curva de 0–50 min de IVGTT; ∆ AUC de glucosa, área de glucosa bajo la curva de 0–50 min de IVGTT; FPG, glucosa enplasma en ayunas; FPI, insulina en plasma en ayunas.
* Significativamente diferente vs al pre-entrenamiento (p <0.05), determinado por análisis post-hoc después de una interacción significativa de tiempo x grupo (T x G).
Fitness cardiorespiratorios
El VO2pico aumentó comparado al pre-entrenamiento por ~12% después de 6 semanas de SIT y MICT (p <0.001 para ambos). El VO2pico aumentó aún más después de 12 semanas comparado a las 6 semanas (p = 0.007 y p = 0.005 para SIT y MICT, respectivamente), produciendo un 19% de aumento total vs pre-entrenamiento (p <0.001 para ambos; Fig. 1). El grupo de CTL mostró sólo pequeños cambios respecto a la línea de base cuando fue medido tanto a las 6 (p = 0.43) como a las 12 (p = 0.99) semanas.
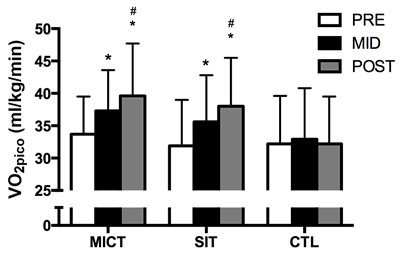
Medido en la línea de base (PRE), 6 semanas (MED), y 12 semanas (POST) en MICT, SIT y CTL. Los valores son promedios ±SD. * p <0.05, vs mismo grupo a PRE; #p <0.05, vs mismo grupo a MED.
Índicies del control glucémico.
El CSI aumentó por 53 y 34% después de 12 semanas de SIT (p = 0.002) y de MICT (p = 0.013; Fig. 2) mientras que el cambio fue pequeño en CON (p = 0.64). La AUC de glucosa durante el IVGTT de 50 minutos se redujo a una magnitud mayor después de SIT (p <0.001) y de MICT (p = 0.001) comparado a CON (p = 0.32). Estos datos y otros índices decontrol glucémico en ayuno se resumen en la Tabla 2.
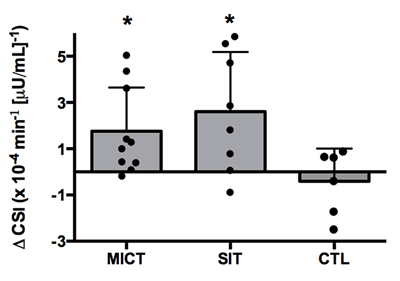
El cambio en la sensibilidad de la insulina (CSI) durante la intervención de 12 semanas, medido a partir de un test de IVGTT de 50 minutos en MICT, SIT y CTL. Los círculos rellenos denotan las respuestas individuales. Los valores son promedios ±SD. * p <0.05, PRE vs POST.
Adapataciones del músculo esquelético
La actividad máxima de la CS aumentó por 48 y 27% después de 12 semanas de SIT (p <0.0001) y de MICT (p = 0.004), respectivamente, y fue superior que el post-entrenamiento de CTL (p = 0.03 para ambos; Fig. 3). El entrenamiento también aumentó la proteína del Complejo II-70kDa (SIT: p <0.001; MICT: p = 0.02) el Complejo III-Core proteína 2 (SIT: p <0.001; MICT: p = 0.003), subunidad de COX IV (SIT: p <0.001; MICT: p = 0.001) y la ATP Sintetasa α-subunidad (SIT: p = 0.001; MICT: p = 0.004), todos estuvieron más altos que el post-entrenamiento de CTL (p <0.05; Fig. 3). El aumento absoluto en la actividad máxima de β-HAD fue de 28% y de 17% en SIT y MICT, respectivamente, comparado a un cambio del -2% en CTL, pero una interacción de tiempo x grupo no fue observado (p = 0.16). El contenido de proteína de GLUT4 aumentó por ~50% después de SIT (p = 0.001) y de MICT (p-0.002), mientras que hubo un cambio pequeño en CTL (p = 0.50; Tabla 2).
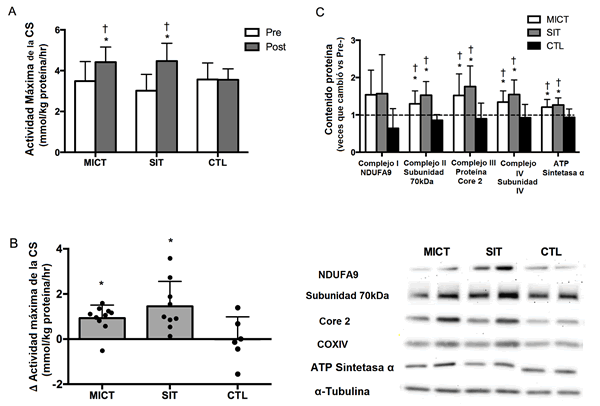
Medido en muestras de biopsias musculares obtenidos del vasto externo antes (PRE) y 96 hs después (POST) de la intervención de 12 semanas en MICT, SIT y CTL. La actividad máxima de la citrato sintetasa (A), cambios individuales en la actividad máxima de la citrato sintetasa (B) y contenido de proteína de distintas subunidad de los complejos en la cadena de transporte de electrones (C). Las manchas Western representativas se pueden ver en la figura. Los valores son promedios ±SD. * p <0.05, vs al mismo grupo en PRE; † p <0.05, vs a CTL en POST.
Discusión
El principal nuevo hallazgo del presente estudio fue que 12 semanas de SIT en hombres previamente inactivos mejoraron la sensibilidad de la insulina, el fitness cardiorespiratorio, y el contenido mitocondrial del músculo esquelético a la misma magnitud como el MICT, a pesar de un volumen del ejercicio y un compromiso de tiempo entrenamiento cinco veces inferiores. El SIT involucró 1 minuto de intenso ejercicio intermitente, dentro de un compromiso de tiempo de 10 minutos por sesión, mientras que el MICT consistió en 50 minutos de ejercicio continuo a un ritmo moderado. Unos pocos estudios previos han reportado mejoras similares en el remodelamiento del músculo esquelético y en marcadores del estatus de salud después de SIT y MICT que duraran arriba de 6 semanas [10,11,13]. El objetivo de este trabajo fue ser más ambicioso en comparación con estudios previos que compararon el SIT con el MICT. Específicamente, se implementó un protocolo de SIT que requirió el compromiso de tiempo total menor que en los estudios previos (es decir, 10 minutos vs ~25 minutos), un programa de entrenamiento que era dos veces más largo (es decir, 12 vs 6 semanas), una medida más robusta de la sensibilidad de la insulina (es decir, un tes de IVGTT vs OGTT y medidas sanguíneas en ayunas de sensibilidad de la insulina), e inclusión de un grupo de control sin entrenamiento.
Fitness cardiorespiratorio
El bajo fitness cardiorespiratorio es un fuerte factor de riesgo independiente para la enfermedad cardiovascular y la mortalidad de todas las causas [25,26]. Se ha conocido por décadas que el entrenamiento intervalado que involucra ebreves esfuerzos duros es un estímulo potente para mejorar el fitness cardiorespiratorio [27,28]. Recientes estudios han demostrado que protocolos que involucran tan sólo un minuto de entrenamiento interválico de sprint por sesión pueden ser muy eficaces a este respecto [15-17]. Antes del presente trabajo, ningún estudio había comparado este tipo de protocolo de SIT directamente con el entrenamiento de la resistencia tradicional como seve reflejado en las pautas de salud pública. Nosotros encontramos un 19% de mejora notablemente similar en el VO2pico después de 12 semanas de SIT y MICT, que se compara favorablemente con el cambio típico reportado después de varios meses de entrenamiento de la resistencia tradicional [29,30].
La intensidad del ejercicio generalmente se considera de ser el factor más crítico en la entrenabilidad del VO2pico, con un ejercicio de intensidad superior que confiere mejoras más grandes sobre el fitness cardiorespiratorio cuando el ejercicio se empareja al gasto energético total [31-34]. Este mensaje fue recientemente reforzado por Ross y cols. [35], quienes encontraron que el ejercicio de baja intensidad (50% VO2pico) realizado durante aproximadamente 150 minutos por semana, durante 24 semanas, no pudo ser suficiente para mejorar el fitness cardiorespiratorio para una proporción sustantiva de adultos. En contraste, los datos presentes demuestran que es posible para individuos previamente sedentarios mejorar su VO2pico notablemente realizando un total de 3 minutos por semana de intensos esfuerzos cortos de ejercicio, dentro de un compromiso de tiempo de 30 minutos durante 12 semanas. El cambio absoluto en el VO2pico relativo fue ~de 6 ml/kg/min en SIT y MICT, lo que corresponde a ~1.7 equivalentes metabólicos (METS). Estos resultados son notables dado que un aumento de 1 MET en lo cardiorespiratorio es comparable a una disminución en la circunferencia de cintura de 7 cm, una disminución de la presión sanguínea sistólica de 5 mmHg o una reducción de 1 mmol/L de la glucosa en plasma en ayunas, en términos de reducción de riesgo relativo en todas las causas y mortalidad de enfermedad cardiovascular [25]. Los individuos con malas condiciones físicas también tienen dos veces un riesgo de muerte sin tener en cuenta el BMI, mientras que los adultos entrenados y adultos con sobrepeso/obesos tienen un riesgo de mortalidad similar como sus pares de peso normal [26].
Los mecanismos precisos responsables del fitness cardiorespiratorio mejorado observado después de SIT y MICT en el presente estudio son desconocidos. El aumento en el VO2pico después del entrenamiento de la resistencia tradicional generalmente se atribuye a un gasto cardíaco mejorado que a un volumen sistólico mayor, aunque numerosos factores pueden contribuir a esta respuesta adaptativa [3]. Un número limitado de estudios ha evaluado las adaptaciones cardiovasculares para SIT y ha producido resultados ambiguos, probablemente debido en parte a las diferencias en el diseño experimental así como los procedimientos analíticos específicos empleados [36,37]. Se han observado aumentos del volumen sistólico de reposo después de 7 semanas de SIT usando una MRI cardíaca [38], ya que el volumen sistólico durante el ejercicio submáximo en base a la técnica de la respiración de CO2 después de 4 semanas de SIT [36]. Al contrario, MacPherson y cols. [37] no reportaron ningún cambio en el gasto cardíaco máximo en base a la técnica de acetileno sin insuflación después de 6 semanas de SIT basado enla carrera. También se ha indicado que factores periféricos que mejoran la extracción de oxígeno pueden contribuir a las mejoras inducidas por SIT sobre el VO2pico, al menos en el corto plazo [39]. Estudios adicionales son necesarios para clarificar el curso de tiempo y los mecanismos precisos responsable de un fitness cardiorespiratorio mejorado después del SIT comparado al MICT.
Sensibilidad de la insulina.
Quizás la forma del hallazgo más llamativa y nueva del trabajo presente fue el aumento similar en la sensibilidad de la insulina después del SIT y del MICT. Se ha demostrado previamente que el SIT mejora los índices del control glucémico, como fue determinado por el método del clamp hiperinsulinémico-euglucémico [40], el monitoreo continuo de la glucosa [17] y los tests orales de tolerancia a la glucosa [13,41]. En la investigación presente, nosotros empleamos un test IVGTT de 50 minutos (CSI) que fue validado recientemente por Tura y colegas como un marcador robusto de la sensibilidad de la insulina [19]. La técnica fue demostrada de estar muy correlacionada con la patrón ‘gold’ de la tasa de infusión de glucosa obtenida durante un clamp hiperinsulinémico-euglucémicoc [19], y tiene una reproductibilidad mayor que el MISI derivado de los OGTTs [20].
Houmard y cols. [42], usando el método de IVGTT, previamente reportaron que un protocolo de entrenamiento continuo que involucra 170 minutos de ejercicio por semana mejoró la sensibilidad de la insulina a una magnitud mayor que 115 minutos por semana, sin tener en cuenta la intensidad y volumen del ejercicio. Varios recientes reportes, sin embargo, indican que cuando el ejercicio se empareja por el volumen total o gasto energético, el entrenamiento físico de mayor intensidad confiere las mejoras más grandes sobre la sensibilidad de la insulina en individuos con obesidad [43], síndrome metabólico [33] y diabetes tipo 2 [31,34]. Nuestros resultados apoyan este concepto general y demuestran que una cantidad sorprendentemente pequeña de ejercicio de alta intensidad puede ser tan eficaz como un volumen grande de ejercicio contínuo de moderada intensidad para mejorar la sensibilidad de la insulina.
Los mecanismos potenciales que median los aumentos inducido por el entrenamiento en la sensibilidad de la insulina en todo el cuerpo, son evidentemente complejos [1]. Nosotros encontramos aumentos similares en el contenido de proteína del GLUT4 después de los dos protocolos de entrenamiento a pesar de las grandes diferencias con respecto a los cambios potenciales en el músculo esquelético, lo que podría explicar la sensibilidad de la insulina mejorada en parte, en el volumen del ejercicio. El SIT y MICT también se ha demostrado que aumentan la densidad microvascular del músculo esquelético similarmente [44], lo cual está asociado con el transporte de glucosa mejorado y la sensibilidad de la insulina [44,45]. También es posible que la mejora en el contenido mitocondrial [1] o una capacidad mayor para la utilización de los triglicéridos intramusculares [12], podría estar involucrada.
Contenido mitocondrial
El menor contenido mitocondrial del músculo esquelético está asociado con un mal uso de los lípidos, una pobre sensibilidad de la insulina y un perfil de salud metabólica anormal [46]. La actividad física aumenta el contenido mitocondrial y la sensibilidad de la insulina, pero permanece incierto si estos efectos están directamente vinculados [1,46]. La actividad máxima de la citrato sintetasa es un marcador normalmente medido que está fuertemente asociado con el contenido mitocondrial en el músculo esquelético humano [47]. Un nuevo hallazgo del trabajo presente fue el aumento similar en la actividad máxima de la citrato sintetasa después de 12 semanas de SIT y MICT, a pesar de la gran diferencia en el volumen de ejercicio total. Nosotros también observamos aumentos similares en el contenido de proteína de varias subunidades de los complejos en la cadena de transporte de electrones, resaltando la adaptación mitocondrial similar en ambos grupos. Nosotros no examinamos el curso de tiempo del remodelamiento del músculo esquelético, pero el aumento promedio en la actividad máxima de lacitrato sintetasa después del entrenamiento fue similar al 30-40% de aumento que nosotros observamos previamente después de 2 [48] y 6 semanas [10,17] de SIT y MICT. Consistente con recientes observaciones de Egan y cols. [49], quienes examinaron el curso de tiempo del mayor contenido mitocondrial en respuesta a 14 sesiones de entrenamiento de la resistencia, estos datos parecen implicar que mucho del aumento en el contenido mitocondrial ocurre relativamente temprano en la respuesta a entrenamiento. Dado el volumen del ejercicio muy inferior involucrado con el SIT, estos datos indican también aparentemente que la intensidad del entrenamiento, en lugar del volumen, puede ser el factor determinante más crítico de la mejora en el contenido mitocondrial. Como recientemente fue revisado por Bishop y cols. [50], un número sorprendentemente pequeño de estudios ha investigado el impacto de variar la intensidad y el volumen del entrenamiento sobre los cambios en la función mitocondrial y su contenido en el músculo esquelético humano, y un trabajo adicional en este tema es necesario..
Eficacia versus efectividad.
Mientras el presente estudio y el trabajo de otros resaltan la eficacia del SIT para mejorar índices de salud cardiometabólica, la efectividad potencial del entrenamiento intervalado en sus distintas formas y probablemente impacta sobre la higiene pública, sigue siendo algo alentador [51]. La investigación en el campo del comportamiento del ejercicio ha demostrado una relación negativa entre la intensidad del ejercicio y el afecto, particularmente en individuos menos entrenados, lo que sugiere que las personas son menos propensas a adherirse a un programa de ejercicio vigoroso ya que se considera aversivo [52,53]. Sin embargo, en un reciente estudio de Jung y cols. [54], los sujetos reportaron un mayor goce, y una preferencia para someterse a un protocolo de ejercicio intermitente de alta intensidad como comparado a un ejercicio continuo de moderada o vigorosa intensidad. El protocolo de intervalos involucró 20 minutos de alternar períodos de 60 segundos de ejercicio al 100% y al 20% Wpico, mientras que los protocolos continuos involucraron un ejercicio al 40% Wpico por 40 minutos o al 80% Wpico durante 20 minutos. Otro trabajo por los mismos autores demostró que la adhesión a un programa de entrenamiento intervalado de alta intensidad de 4 semanas, evaluada por auto-reportes en condiciones de la vida diaria, era mayor que para el ejercicio contínuo de moderada intensidad en personas con prediabetes [55]. Estos resultados resaltan la utilidad potencial del entrenamiento intervalado intenso como estrategia alternativa de ejercicio, lo que podría sostener la adhesión al ejercicio, pero estudios más largos y más comprehensivos son necesarios para esta consideración.
Conclusión
En resumen, nosotros reportamos que un protocolo de SIT que involucra 3 minutos de ejercicio intermitente intenso por semana, dentro de un compromiso de tiempo total de 30 minutos, es tan eficaz como 150 minutos por semana de entrenamiento contínuo de moderada intensidad para una mayor sensibilidad de la insulina, fitness cardiorespiratorio y contenido mitocondrial del músculo esquelético en hombres previamente inactivos. Esta investigación representa la comparación más larga de SIT y MICT a la fecha y demuestra la eficacia del ejercicio breve e intenso para mejorar índices de salud cardiometabólica. Mientras el SIT claramente es un estímulo potente para provocar adaptaciones fisiológicas, este tipo de ejercicio requiere un nivel muy alto de motivación y claramente no se ajusta a todo el mundo. Los estudios futuros deben examinar el potencial para protocolos de entrenamiento intervalado que involucren esfuerzos relativamente intensos pero no "extremos" para producir los cambios así demostrados en el presente estudio. Considerando que un número grande de individuos no se vincula a las recomendaciones de la actividad física actuales [56,57], hay un valor en explorar los beneficios potenciales de estrategias de ejercicio que involucren un compromiso de tiempo reducido. Se necesitan pruebas clínicas aleatorizadas en gran escala para avanzar en este campo.
Iinformación de apoyo.
Muestra 1/1: S1 Fig. PDF
S1 Fig. Descriptive Characteristics and Markers of Glycemic Control.
(PDF)
Agradecimientos:
Nosotros agradecemos a la Rachel Tan y Micaela Gregory por la ayuda con el entrenamiento físico.
REFERENCIAS
1. Hawley JA. (2004). Exercise as a therapeutic intervention for the prevention and treatment of insulin resistance. Diabetes Metab Res Rev. 2004;20: 383–393.
2. Warburton DER, Nicol CW, Bredin SSD. (2006). Health benefits of physical activity: the evidence. Can Med Assoc J. 2006;174: 801–809.
3. Blomqvist CG, Saltin B. (1983). Cardiovascular adaptations to physical training. Annu Rev Physiol. 1983;45: 169–189.
4. Holloszy JO, Coyle EF. (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J Appl Physiol. 1984;56: 831–838.
5. World Health Organization. (2010). Global Recommendations on Physical Activity For Health. WHO Library Cataloguing-in-Publication Data. 2010. ISBN 978 92 4 159 997 9.
6. Garber CE, Blissmer B, Deschenes MR, Franklin B a, Lamonte MJ, Lee I-M, et al. American College of Sports Medicine position stand. (2011). Quantity and quality of exercise for developing and maintaining cardiorespiratory, musculoskeletal, and neuromotor fitness in apparently healthy adults: guidance for prescribing exercise. Med Sci Sports Exerc. 2011;43: 1334–59.
7. Tremblay MS, Warburton DER, Janssen I, Paterson DH, Latimer AE, Rhodes RE, et al. (2011). New Canadian Physical Activity Guidelines. Appl Physiol Nutr Metab. 2011;36: 36–46.
8. Trost SG, Owen N, Bauman AE, Sallis JF, Brown W. (2001). Correlates of adults’ participation in physical activity: review and update. Med Sci Sports Exerc. 2002;34: 1996–2001.
9. Weston KS, Wisløff U, Coombes JS. (2014). High-intensity interval training in patients with lifestyle-induced cardiometabolic disease: a systematic review and meta-analysis. Br J Sports Med. 2014;48: 1227–34.
10. Burgomaster KA, Howarth KR, Phillips SM, Rakobowchuk M, Macdonald MJ, McGee SL, et al. (2008). Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. J Physiol. 2008;586: 151–60.
11. Gibala MJ, Little JP, van Essen M, Wilkin GP, Burgomaster KA, Safdar A, et al. (2006). Short-term sprint interval versus traditional endurance training: similar initial adaptations in human skeletal muscle and exercise performance. J Physiol. 2006;575: 901–11.
12. Shepherd SO, Cocks M, Tipton KD, Ranasinghe AM, Barker TA, Burniston JG, et al. (2013). Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5. J Physiol. 2013;591: 657–75.
13. Cocks M, Shaw CS, Shepherd SO, Fisher JP, Ranasinghe AM, Barker TA, et al. (2013). Sprint interval and endurance training are equally effective in increasing muscle microvascular density and eNOS content in sedentary males. J Physiol. 2013;591: 641–56.
14. Gillen JB, Gibala MJ. (2014). Is high-intensity interval training a time-efficient exercise strategy to improve health and fitness? Appl Physiol Nutr Metab. 2014;39: 409–12.
15. Metcalfe RS, Babraj JA, Fawkner SG, Vollaard NBJ. (2011). Towards the minimal amount of exercise for improving metabolic health: beneficial effects of reduced-exertion high-intensity interval training. Eur J Appl Physiol. 2011;112: 2767–75.
16. Ma JK, Scribbans TD, Edgett BA, Boyd JC, Simpson CA, Little JP, et al. (2013). Extremely low-volume, high-intensity interval training improves exercise capacity and increases mitochondrial protein content in human skeletal muscle. J Mol Integr Physiol. 2013;3: 202–210.
17. Gillen JB, Percival ME, Skelly LE, Martin BJ, Tan RB, Tarnopolsky MA, et al. (2014). Three minutes of all-out intermittent exercise per week increases skeletal muscle oxidative capacity and improves cardiometabolic health. PLoS One. 2014;9: e111489.
18. Tarnopolsky MA, Pearce E, Smith K, Lach B. (2011). Suction-modified Bergström muscle biopsy technique: experience with 13,500 procedures. Muscle Nerve. 2011;43: 717–25.
19. Tura A, Sbrignadello S, Succurro E, Groop L, Sesti G, Pacini G. (2010). An empirical index of insulin sensitivity from short IVGTT: validation against the minimal model and glucose clamp indices in patients with different clinical characteristics. Diabetologia. 2010;53: 144–52.
20. Ortega J, Hamouti N, Fernandez-Elias V, Mora-rodriguez R. (2014). Comparison of glucose tolerance tests to detect the insulin sensitizing effects of a bout of continuous exercise. Appl Physiol Nutr Metab. 2014;39: 787–792.
21. Ortega J, Fernandez-Elias V, Hamouti N, Garcia-Pallares J, Mora-Rodriguez R. (2015). Higher Insulin-sensitizing Response after Sprint Interval Compared to Continuous Exercise. Int J Sport Med. 2015;36: 209–14.
22. Matsuda M, DeFronzo RA. (1999). Insulin sensitivity indices obtained from oral glucose tolerance testing. Diabetes Care. 1999;22: 1462–1470.
23. Carter SL, Rennie CD, Hamilton SJ, Tarnopolsky MA. (2001). Changes in skeletal muscle in males and females following endurance training. Can J Physiol Pharmacol. 2001;79: 386–392.
24. Little JP, Gillen JB, Percival M, Safdar A, Tarnopolsky MA, Punthakee Z, et al. (2011). Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes. J Appl Physiol. 2011;111: 1554–1560.
25. Kodama S. (2009). Cardiorespiratory Fitness as a Quantitative Predictor of All-Cause Mortality and Cardiovascular Events. JAMA. 2009;301: 2024–35.
26. Barry VW, Baruth M, Beets MW, Durstine JL, Liu J, Blair SN. (2014). Fitness vs. fatness on all-cause mortality: a meta-analysis. Prog Cardiovasc Dis. Elsevier Inc.; 2014;56: 382–90.
27. Knuttgen HG, Nordesjo LO, Ollander B, Saltin B. (1973). Physical Conditioning through interval training with young male adults. Med Sci Sports. 1973;5: 220–226.
28. Tabata I, Nishimura K, Kouzaki M, Y H, Ogita F, Miyachi M, et al. (1996). Effects of moderate-intensity endurance and high-intensity intermittent training on anaerobic capacity and VO2max. Med Sci Sports Exerc. 1996;28: 1327–1330.
29. Murias JM, Kowalchuk JM, Paterson DH. (2010). Time course and mechanisms of adaptations in cardiorespiratory fitness with endurance training in older and young men. J Appl Physiol. 2010;108: 621–627.
30. Samjoo IA, Safdar A, Hamadeh MJ, Raha S, Tarnopolsky MA. (2013). The effect of endurance exercise on both skeletal muscle and systemic oxidative stress in previously sedentary obese men. Nutr Diabetes. Nature Publishing Group; 2013;3: e88.
31. Boulé NG, Kenny GP, Haddad E, Wells GA, Sigal RJ. (2003). Meta-analysis of the effect of structured exercise training on cardiorespiratory fitness in Type 2 diabetes mellitus. Diabetologia. 2003;46: 1071–1081.
32. Gormley SE, Swain DP, High R, Spina RJ, Dowling EA, Kotipalli US, et al. (2008). Effect of intensity of aerobic training on VO2max. Med Sci Sports Exerc. 2008;40: 1336–1343.
33. Tjønna AE, Lee SJ, Rognmo Ø, Stølen TO, Bye A, Haram PM, et al. (2008). Aerobic interval training versus continuous moderate exercise as a treatment for the metabolic syndrome: a pilot study. Circulation. 2008;118: 346–54.
34. Karstoft K, Thomsen C, Winding K, Pedersen B, Knudsen S, Solomon T, et al. (2012). The Effects of Free-Living Interval- Walking Training on Glycemic Control, Body Composition, and Physical Fitness in Type 2 Diabetes Patients. Diabetes Care. 2012;36: 228–36.
35. Ross R, de Lannoy L, Stotz PJ. (2015). Separate Effects of Intensity and Amount of Exercise on Interindividual Cardiorespiratory Fitness Response. Mayo Clin Proc. Elsevier Inc; 2015; 1–9.
36. Trilk JL, Singhal A, Bigelman KA, Cureton KJ. (2011). Effect of sprint interval training on circulatory function during exercise in sedentary, overweight/obese women. Eur J Appl Physiol. 2011;111: 1591–1597.
37. MacPherson REK, Hazell TJ, Olver TD, Paterson DH, Lemon PWR. (2011). Run sprint interval training improves aerobic performance but not maximal cardiac output. Med Sci Sports Exerc. 2011;43: 115–22.
38. Matsuo T, Saotome K, Seino S, Shimojo N, Matsushita A, Iemitsu M, et al. (2014). Effects of a low-volume aerobic-type interval exercise on O 2max and cardiac mass. Med Sci Sports Exerc. 2014;46: 42–50.
39. Sloth M, Sloth D, Overgaard K, Dalgas U. (2013). Effects of sprint interval training on VO2max and aerobic exercise performance: A systematic review and meta-analysis. Scand J Med Sci Sports. 2013;23: 341–352.
40. Richards JC, Johnson TK, Kuzma JN, Lonac MC, Schweder MM, Voyles WF, et al. (2010). Short-term sprint interval training increases insulin sensitivity in healthy adults but does not affect the thermogenic response to beta-adrenergic stimulation. J Physiol. 2010;588: 2961–72.
41. Babraj JA, Vollaard NBJ, Keast C, Guppy FM, Cottrell G, Timmons JA. (2009). Extremely short duration high intensity interval training substantially improves insulin action in young healthy males. BMC Endocr Disord. 2009;9: 1–8.
42. Houmard JA, Tanner CJ, Slentz CA, Duscha BD, McCartney JS, Kraus WE. (2004). Effect of the volume and intensity of exercise training on insulin sensitivity. J Appl Physiol. 2004;96: 101–106.
43. Ross R, Hudson R, Stotz PJ, Lam M. (2015). Effects of Exercise Amount and Intensity on Abdominal Obesity and Glucose Tolerance in Obese Adults. Ann Intern Med. 2015;162: 325–41.
44. Cocks M, Shaw CS, Shepherd SO, Fisher JP, Ranasinghe A, Barker TA, et al. (2015). Sprint interval and moderate-intensity continuous training have equal benefits on aerobic capacity, insulin sensitivity, muscle capillarisation and endothelial eNOS/NAD(P)Hoxidase protein ratio in obese men. J Physiol. 2015; 1–15.
45. Akerstrom T, Laub L, Vedel K, Brand CL, Pedersen BK, Lindqvist AK, et al. (2014). Increased skeletal muscle capillarization enhances insulin sensitivity. AJP Endocrinol Metab. 2014;307: E1105–E1116.
46. Stephenson EJ, Hawley JA. (2014). Mitochondrial function in metabolic health: a genetic and environmental tug of war. Biochim Biophys Acta. Elsevier B.V.; 2014;1840: 1285–94.
47. Larsen S, Nielsen J, Hansen CN, Nielsen LB, Wibrand F, Stride N, et al. (2012). Biomarkers of mitochondrial content in skeletal muscle of healthy young human subjects. J Physiol. 2012;590: 3349–60.
48. Burgomaster KA, Hughes SC, Heigenhauser GJF, Bradwell SN, Gibala MJ. (2005). Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. J Appl Physiol. 2005;98: 1985–90.
49. Egan B, O’Connor PL, Zierath JR, O’Gorman DJ. (2013). Time Course Analysis Reveals Gene-Specific Transcript and Protein Kinetics of Adaptation to Short-Term Aerobic Exercise Training in Human Skeletal Muscle. PLoS One. 2013;8: e74098.
50. Bishop DJ, Granata C, Eynon N. (2014). Can we optimise the exercise training prescription to maximise improvements in mitochondria function and content? Biochim Biophys Acta. Elsevier B.V.; 2014;1840: 1266–75.
51. Biddle SJH, Batterham AM. (2015). High-intensity interval exercise training for public health: a big HIT or shall we HIT it on the head? Int J Behav Nutr Phys Act. International Journal of Behavioral Nutrition and Physical Activity; 2015;12: 95.
52. Ekkekakis P. (2009). Let Them Roam Free? Sport Med. 2009;39: 857–888.
53. Parfitt G, Hughes S. (2009). The Exercise Intensity–Affect Relationship: Evidence and Implications for Exercise Behavior. J Exerc Sci Fit. Elsevier (Singapore) Pte Ltd; 2009;7: S34–S41.
54. Jung ME, Bourne JE, Little JP. (2014). Where does HIT fit? An examination of the affective response to high-intensity intervals in comparison to continuous moderate- and continuous vigorous-intensity exercise in the exercise intensity-affect continuum. PLoS One. 2014;9: e114541.
55. Jung ME, Bourne JE, Beauchamp MR, Robinson E, Little JP. (2015). High-Intensity Interval Training as an Efficacious Alternative to Moderate-Intensity Continuous Training for Adults with Prediabetes. J Diabetes Res. 2015;2015: 1–9.
56. Colley RC, Garriguet D, Janssen I, Craig CL, Clarke J, Tremblay MS. (2011). Physical activity of Canadian adults: accelerometer results from the 2007 to 2009 Canadian Health Measures Survey. Stat Canada. 2011;22: 7–14.
57. Troiano RP, Berrigan D, Dodd KW, Mâsse LC, Tilert T, Mcdowell M. (2008). Physical activity in the United States measured by accelerometer. Med Sci Sports Exerc. 2008;40: 181–188.
Aumento inducido por el ejercicio en el factor neurotrófico derivado del cerebro (BDNF) en personas con esclerosis múltiple: Una revisión sistemática y metaanálisis de ensayos de intervención de ejercicio
El papel del Factor Neurotrófico Derivado del Cerebro (BDNF) en la esclerosis múltiple (EM) ha...
El volumen de caminata rápida es el factor clave para la mejora de la DMO en mujeres en premenopausia
Brisk Walking y Densidad Mineral Ósea: Clave para las Mujeres Premenopáusicas La osteoporosis es...
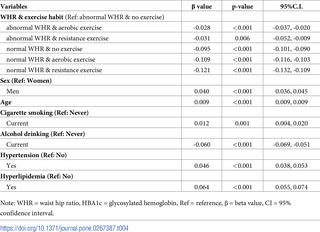
Efectos del ejercicio aeróbico y de resistencia en las concentraciones de hemoglobina glucosilada (HbA1c) en individuos taiwaneses no diabéticos según la relación cintura-cadera
El estudio analiza la relación entre los niveles de hemoglobina glucosilada (HbA1c) y la práctica...
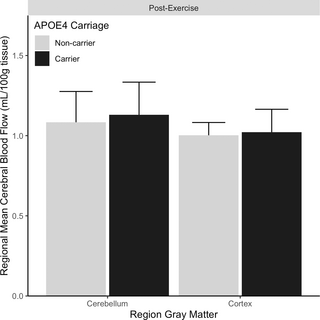
Riesgo de demencia y respuesta dinámica al ejercicio: Un ensayo clínico no randomizado
Resumen El ejercicio físico ha mostrado ser un aliado clave para la salud cerebral y la cognición...
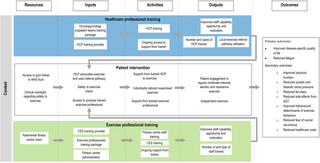
Evaluación del proceso para el ensayo controlado aleatorizado STAMINA: Un protocolo
Evaluación del Proceso del Ensayo Controlado Aleatorizado STAMINA Introducción El ensayo STAMINA...