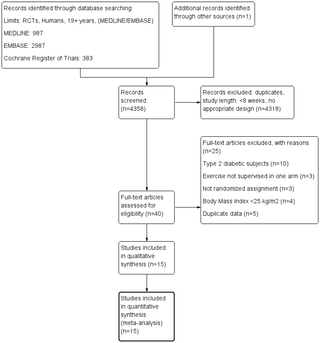
Resumen
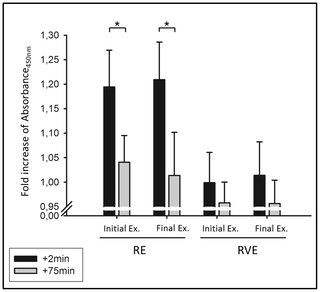
Las células satelitales (SC) están asociadas con la remodelación del músculo esquelético después del daño muscular y/o una hipertrofia extensa resultante del entrenamiento de resistencia (RT). Recientemente informamos que los aumentos tempranos en la síntesis de proteínas musculares (MP) durante la RT parecen estar dirigidas hacia la reparación del daño muscular, pero los MP contribuyen a la hipertrofia con la atenuación progresiva del daño muscular. Sin embargo, las modulaciones en contenido de SC agudo y crónico con RT durante la inicial (1calle-wk: daños altos), temprano (3rd-Wk: daño atenuado), y más tarde (10th-wk: sin daño) las etapas no están bien caracterizadas. Diez hombres jóvenes (27 ± 1 y, 23.6 ± 1.0 kg · m-2) Se sometieron a 10 semanas de RT y biopsias musculares (vasto-lateral) antes (pre) y post (48h) el 1calle (T1), 5th (T2) y finales (T3) sesiones RT para evaluar el contenido de SC específico de tipo fibra, área de sección transversal (FCSA) y número mionuclear por inmunohistoquímica. Observamos la hipertrofia inducida por RT después de 10 semanas de RT (FCSA aumentó ~ 16% en Tipo II, PAG <0.04; ~ 8% en Tipo I (NS)). El contenido de SC aumentó 48H después del ejercicio en T1 (~ 69% en Tipo I (PAG = 0.014); ~ 42%en Tipo II (NS)), y este aumento se mantuvo a lo largo de RT (anterior a T2: ~ 65%, ~ 92%; Pre T3: ~ 30%(NS), ~ 87%, para el aumento de Tipo I y II, respectivamente, vs. Pre T1 (PAG <0.05)). El aumento del contenido de SC no se combinó con cambios en el número myonuclear. SC tiene un papel más pronunciado en la reparación muscular durante la fase inicial de la RT que la hipertrofia muscular resultó de RT de 10 semanas en hombres jóvenes. El tamaño crónico de la piscina SC elevada con RT es importante que proporciona un entorno adecuado para tensiones futuras o aumentos más grandes de la FCSA.
Introducción
La masa del músculo esquelético está determinada por el equilibrio entre las tasas de rotación de proteínas (síntesis de proteínas musculares (MP) y descomposición). La rotación de proteínas está regulada hasta cierto punto por la transcripción génica de los myonuclei posmitóticos preexistentes dentro de las fibras, que se cree que controlan un volumen finito de citoplasma (denominado dominio myonuclear o unidad de ADN (1)). Sin embargo, el número de mionuclear se puede aumentar a través de la donación de las células madre musculares, también conocidas como células satelitales (SC). SC sufre proliferación, diferenciación y fusión a las fibras musculares en condiciones que requieren una mayor capacidad transcripcional (2, 3), como el daño muscular (4–6) y grandes aumentos en el tamaño de la fibra muscular (7–9).
Recientemente demostramos que las sesiones iniciales de entrenamiento de resistencia (RT) dan como resultado un daño muscular significativo que requiere un aumento del ejercicio posterior al ejercicio (RE) MP que parece dirigido hacia la reparación (10). Sin embargo, el daño muscular se atenúa progresivamente a medida que avanza la RT y los MP, propusimos, dirigido más hacia la promoción de la hipertrofia muscular (10). Como SC participa en la reparación del daño muscular y el apoyo a la hipertrofia, es interesante determinar la respuesta de estas células a lo largo de un programa RT. Anteriormente, los estudios demostraron que los protocolos RE inductores de daños musculares aumentaron el número de SC 24-72H después de RE (5, 11); mientras que la ablación de SC perjudica la regeneración del tejido muscular después de la lesión (4) o ejercicio (12). Sin embargo, no está claro si la expansión aguda inducida por el daño de SC se traduce en un aumento en el contenido mionuclear. Los estudios han informado que el daño muscular reinducido promueve los aumentos en el tamaño de la piscina SC, pero no resultan en un aumento en el contenido mionuclear de hasta 120 h después del combate (5) o incluso más tarde (27 días después del combate) (13). Por lo tanto, proponemos que en un programa RT regular, donde el daño muscular es leve a moderado después de la primera sesión de RE, pero disminuye de forma rápida y progresiva en magnitud a través de RT (10), La contribución de los núcleos puede ser necesaria solo para soportar el crecimiento continuo de la fibra muscular (es decir, una gran magnitud de la hipertrofia de la fibra muscular). Una teoría laboral es que a medida que avanza la RT y el tamaño de la fibra se expande más allá de la capacidad transcripcional de los myonuclei existentes, se pueden requerir núcleos SC (7–9, 14, 15).
En el estudio actual, nuestro objetivo fue extenderse sobre resultados anteriores (10) Examinando los cambios en el contenido de SC de las fibras musculares tipo I y tipo II antes y después de las reisiones en diferentes fases de un programa RT: al inicio (Semana 1, T1) donde la reparación del músculo esquelético es una función dominante de los MP; en una fase temprana (Semana 3, T2) donde se atenúa el daño en comparación con T1; y en una fase posterior (Semana 10, T3) donde el daño muscular se atenúa en gran medida. Además, determinamos el área transversal de la fibra muscular (FCSA), el contenido myonuclear y el tamaño del dominio en las fibras musculares tipo I y II, en los mismos puntos de tiempo. Presumimos que en el estado no capacitado el contenido de SC aumentaría en respuesta a daños sin cambios detectables en el número de myonuclei en un punto de tiempo temprano (es decir, tercera semana, T2). Sin embargo, a medida que avanza la RT y las personas experimentan un daño muscular progresivamente menos, esperábamos que la FCSA aumente, la expansión de la piscina SC se mantendrá elevada crónica y se observan aumentos en el número mionuclear por fibra, pero sin cambios en el tamaño del dominio mionuclear.
Métodos
Participantes
Las biopsias musculares examinadas en este documento para el análisis inmunohistoquímico se recolectaron de 10 jóvenes sanos que tenían experiencia previa en RT inferior de las extremidades (pero no se habían involucrado en la RT inferior de las extremidades durante al menos 6 meses antes del comienzo del estudio) y participaban en un estudio previo (16). El presente estudio fue aprobado por el Comité de Ética de Investigación Humana de la Universidad local (608.754, 27 de marzo de 2014) y todos los procedimientos realizados en este documento estaban de acuerdo con la Declaración de Helsinki. Todos los sujetos firmaron un formulario de consentimiento informado por escrito antes de la inscripción en el estudio.
Diseño experimental
Los participantes realizaron RT de la parte inferior del cuerpo durante 10 semanas (dos veces por semana, totalizando 19 entrenamientos). Las biopsias musculares se obtuvieron antes (pre) y post-RE (48H) en tres fases de entrenamiento durante todo el período experimental: primer entrenamiento (T1), quinto entrenamiento (T2) y el diecinete de entrenamiento (T3). Las biopsias previas en T2 y T3 se tomaron 120 h después de la última pelea de entrenamiento. Las biopsias musculares se utilizaron para análisis inmunohistoquímicos específicos por tipo de fibra (I y II), incluidos FCSA, contenido mionuclear y tamaño de dominio, y contenido SC. Como la presente investigación destinada a extender los resultados de nuestro estudio anterior, debe tenerse en cuenta que nuestra primera sesión de RE (en T1) promovió la mayor magnitud de daño muscular (indica por la transmisión de banda Z, y los marcadores indirectos, como la pérdida de la fuerza muscular, el aumento de la dolor muscular y las proteínas muscular10).
Control de la dieta y las actividades físicas
La dieta se estandarizó en los días de biopsias (22% de proteína, 41% de carbohidratos y 37% de lípidos). Además, cada participante ingirió 25 g de proteína de suero aislada inmediatamente después de cada pelea de RT (durante el período RT). Durante el período experimental, los participantes recibieron instrucciones de mantener sus hábitos alimenticios normales, no consumir ningún otro suplemento y abstenerse de otras actividades físicas 72 h antes de T1 y durante todo el período de estudio.
Entrenamiento de resistencia
El protocolo RT consistió en 3 conjuntos de 45 ° Press de pierna seguido de 3 conjuntos de ejercicios de extensión de las piernas con reposo 90 entre conjuntos y ejercicios. Cada conjunto consistió en 9-12 repeticiones máximas (realizadas con fatiga volitiva), induciendo ajustes de carga constantes a través de conjuntos y reesiones para mantener el rango de repetición máximo (10, 16). Por lo tanto, en las semanas de evaluaciones (es decir, T1, T2 y T3), la RE se realizó con la misma carga relativa (máxima).
Biopsia muscular
Las muestras musculares se recogieron del vasto lateral (VL) utilizando la técnica de biopsia percutánea con succión, realizada por un médico experimentado. Se realizaron muestras secuenciales en piernas alternos; Sin embargo, las biopsias previas siempre se realizaron en la misma pierna en T1, T2 y T3. Este procedimiento se realizó para que la misma secuencia de piernas se biopsió en T1, T2 y T3 y, por lo tanto, reduce la variabilidad entre las semanas de prueba. El procedimiento de biopsia implicó la administración de anestesia local (2–3 ml de xilocaína al 1% (lignocaína)) y mediante una pequeña incisión, se eliminaron ~ 20-30 mg de músculo usando una aguja Bergström. El tejido se disecó libre de sangre y tejido conectivo y se colocó en una temperatura de corte óptima (OCT) medio de incrustación con sus fibras perpendiculares a la superficie horizontal y congelada rápida en isopentano enfriado por nitrógeno líquido. Inmediatamente después de la preparación, todos los tejidos se congelaron en nitrógeno líquido y se almacenaron a -80 ° C hasta el análisis.
Análisis inmunohistoquímicos
Las secciones transversales musculares (7 μm) se prepararon a partir de muestras montadas con OCT, y luego se llevaron a temperatura ambiente y se fijaron en 2% de paraformaldehído (PFA) durante 10 minutos, lavadas y bloqueadas luego durante 90 minutos en PBS (conteniendo albúmina sérica bovina al 2% (BSA), 5% de suero fetal fetal, 0.02% tritonm (Gs)). Para la cuantificación del contenido de SC tipo I y tipo II, los portaobjetos se incubaron con anticuerpos primarios contra Pax7, laminina, MHCI y MHCII. Todos los anticuerpos secundarios fueron de Invitrogen (Burlington, Canadá). La información detallada de anticuerpos se encuentra en Tabla 1.
Los núcleos se visualizaron con 40.6 diamidino-2-fenilindol (DAPI 1:20 000, Sigma-Aldrich, Oakville, ON, Canadá) antes de cubrirse diapositivas con medios de montaje fluorescentes (Dako, Burlington, On, Canadá). Las imágenes se observaron con un microscopio Nikon Eclipse 90i con un aumento de 20X y se capturaron con una cámara fluorescente de fotométricos Snap HQ2 (Nikon Instrument, Melville, Nueva York, EE. UU.). Los análisis se completaron utilizando el software Nikon NIS-Elements AR Software (Nikon Instruments, Nueva York, EE. UU.) En una gran escala de imágenes. Una imagen representativa se representa en Fig. 1. Para las mediciones de FCSA específicas de tipo fibra, el área de cada fibra muscular individual se calculó utilizando planimetría computarizada (es decir, el perímetro de cada fibra individual delimitada por laminina fluorescente se contorneó manualmente usando un ratón DPI alto). Todas las áreas seleccionadas para análisis estaban libres de artefactos de fractura por congelación y se tuvo cuidado de que las fibras longitudinales no se consideraron en el análisis. Las fibras musculares en la periferia de las secciones transversales musculares también se excluyeron del análisis. El número de myonuclei en las fibras musculares tipo I y II se contó y se normalizó por el número respectivo de fibras musculares analizadas. El tamaño del dominio mionuclear se determinó como una relación entre el tipo de fibra FCSA específico y el número normalizado de myonuclei por tipo de fibra. El número de SC asociado con las fibras musculares tipo I y II se determinó a través de la localización conjunta de Pax7+ + y DAPI en cada tipo de fibra muscular. Posteriormente, normalizamos el contenido de SC específico del tipo de fibra por número de fibras musculares tipo I y II analizadas. Se analizaron un promedio (rango) de 49 (35–50) fibras tipo I y 50 (50–50) fibras tipo II para FCSA, contenido mionuclear y tamaño de dominio. Para el contenido de SC específico del tipo de fibra, se analizaron un promedio (rango) de 99 (48–201) fibras tipo I y 235 (63–552) fibras tipo II. Todos los análisis de inmunofluorescencia fueron completados por el mismo investigador experimentado de manera cegada. La fiabilidad (error típico) entre las mediciones fue buena (FCSA: 94.3 μmetro2; Contenido myonuclear: 0.15 myonuclei/fibra; y contenido de SC: 0.01 SC/fibra).
(A) MHCI/Laminin; (b) mhcii; (c) DAPI; (d) pax7; y (e) mhci/laminin/mhcii/pax7 (fusión). Las flechas denota SC (flecha superior: celda SC asociada con una fibra tipo II; flecha inferior: celda SC asociada con una fibra de tipo I).