PRÓLOGO
El propósito de este texto es proveer a estudiantes, docentes o profesionales interesados en mejorar su conocimiento sobre el metabolismo fosfocálcico, bases racionales sólidas para encarar el problema, fundadas en algunos principios cibernéticos elementales. Muchos de estos conceptos generales (que responden al objetivo de información básica de la presente sección) tendrán numerosas aplicaciones en el campo de la Fisiología del Ejercicio y de la Ciencias Aplicadas al Deporte.
El objetivo no es brindar conocimientos de avanzada, ni proponer hipótesis no demostradas aún, sino simplemente ofrecer recursos didácticos para aprender (o enseñar) este complejo tema de la manera más sencilla posible. Por tal razón, se incurre frecuentemente en simplificaciones que pueden parecer excesivas al lector especializado, pero que resultan invalorables para el principiante.
Lo bibliografía no siempre se refiere a los autores que describieron los fenómenos por primera vez, sino a trabajos en los cuales se pueden encontrar referencias y ampliaciones abundantes, y pone especial énfasis en las publicaciones que exponen las concepciones y la experiencia del propio autor.
INTRODUCCIÓN
Las células de los metazoos son sistemas bioquímicos abiertos, en el sentido termodinámico, pero también constituyen talleres cerrados en ciertos aspectos, desde el punto de visto estructural.
Muchos elementos se encuentran dentro de las células en diferente concentración que en el ambiente líquido (medio interno) en el cual están inmersas y también de un tejido a otro según su respectiva participación en los trabajos metabólicos. Uno de los más importantes elementos es, sin duda, el calcio.
Generalmente hablando, el calcio es un elemento muy crítico para la fisiología celular debido a que su concentración debe cambiar a veces en forma muy frecuente y rápida en los diversos compartimientos celulares14. Uno de los ejemplos más típicos de este fenómeno es el batir de alas de los insectos, para cuya producción la concentración de calcio en cierto compartimiento especial de cada célula muscular debe aumentar y disminuir sucesivamente una vez por cada movimiento.
Es posible que sea ésta la razón por la cual la naturaleza arregló las cosas de tal forma que cada célula contiene solamente pequeñas cantidades de calcio, a pesar de la relativa abundancia de ese elemento en el medio interno. Las células deben imprescindiblemente contener una escasa cantidad de calcio, como condición necesaria para el cambio fácil y rápido de su concentración citoplasmática, donde y cuando sea necesario cada vez.
Las células, en efecto, son estructuras pobres en calcio, tales que su concentración puede cambiar rápidamente a la mitad, al décimo, al centésimo -o al doble, al décuplo, al céntuplo- según las circunstancias. Pero, contrariamente, el medio interno es tan rico en calcio, que su concentración casi nunca sufre grandes cambios, ni aún a la mitad o al doble, ni puede tampoco variar rápidamente.
Sin embargo, la concentración de calcio del medio interno es también importante fisiológicamente, porque puede influir indirectamente sobre la concentración intracelular de calcio a través de las membranas plasmáticas. En relación con esta posibilidad, las células poseen mecanismos activos especiales, a nivel molecular, llamados “bombas”, para expulsar el calcio que haya ingresado en ellas en exceso. Además, la concentración de calcio extracelular influye sobre los mecanismos de coagulación de la sangre, la adhesividad celular en cada tejido, las reacciones inmunológicas, la contractilidad de los músculos, la permeabilidad de los vasos, la secreción de ciertas hormonas, y, especialmente importante para el presente tema, la composición mineral de los huesos.
Los cambios patológicos de la concentración de calcio del medio interno no afectan gravemente a tantas variables como las enumeradas; sin embargo, sus efectos son serios para el organismo, al menos en dos circunstancias importantes:
- Cuando la concentración cálcica del medio interno desciende mucho, los músculos tienden a contraerse involuntariamente y se padece de la así denominada tetania (no confundir el término con el tétanos, enfermedad específica causada por el germen C. tetani).
- Cuando la concentración cálcica del medio interno aumenta mucho, existe el peligro de la calcificación de los tejidos blandos (esto es, de todos los tejidos distintos del óseo) (23, 24). En consecuencia, no debe extrañar que la concentración de calcio en el medio interno sea una variable biológica muy bien controlada en muchos seres vivos (25). En el hombre, la concentración cálcica del medio interno equivale a la de la sangre (calcemia. CaS), debido a que los valores sanguíneos son completamente permeables al calcio. Por consiguiente, a partir de ahora, utilizaremos el símbolo CaS en lugar de la expresión “la concentración cálcica del medio interno”, y definimos “hipercalcemia” e “hipocalcemia” como los estados en los cuales dicha concentración respectivamente aumenta o disminuye.
MOVIMIENTO del CALCIO en el CUERPO HUMANO
Nos referiremos al movimiento del calcio en relación con los mecanismos por los cuales la CaS es una de las variables mejor controladas del organismo, y estudiaremos el biosistema cibernético que la regula.
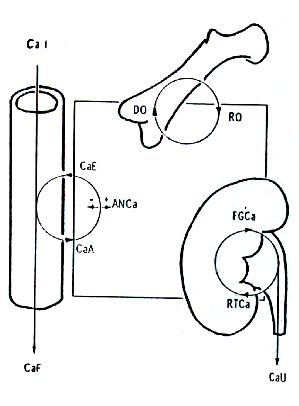
Comprensiblemente, todos los órganos utilizan calcio para su trabajo fisiológico, y de esta manera interaccionan con la CaS, en mayor o menor grado. Sin embargo, se sabe que el trabajo de solamente tres aparatos (o subsistemas orgánicos) da cuenta del movimiento de tanto como el 99% del calcio en el organismo entero. Estos son: el tubo intestinal, el aparato urinario y el esqueleto. La Figura 1 muestra los tres subsistemas interactuantes mediante un esquema básico y simple, en el cual el medio interno, representado por el rectángulo central, los interrelociona funcionalmente. Los tres círculos representan el movimiento del calcio hacia o desde el medio interno (es decir, el intercambio del calcio) para cada subsistema.
Como resulta notorio, cada subsistema posee características propias en lo referente a su comunicación con el medio exterior:
- El intestino presenta una cavidad interior, comunicante al exterior por medio de dos orificios, uno de entrada y otro de salida.
- El aparato urinario posee también una cavidad para conducción, pero solo presenta un orificio de salido.
- El esqueleto, razonablemente, no presenta cavidades interiores en este sentido ni orificios de entrada o de salida.
Estos orificios, los vectores o flechas del esquema, y los respectivos sentidos en que funcionan, definen el papel que cada uno de los tres subsistemas juega como parte del sistema regulador integral cuya descripción se completará después (2, 25). Analizaremos estos roles uno por vez.
Figura 1
EL INTESTINO
El calcio se ingiere (principalmente con los productos lácteos) y se excreta; pero la cantidad eliminada (calcio fecal, CaF) raramente iguala a la que ingresa (calcio ingerido. Cal) en el correspondiente período (5,20). El calcio es también absorbido de la luz intestinal al medio interno (CaA). Algo de calcio llega a lo cavidad intestinal no por la boca, sino junto con los jugos digestivos, provenientes del medio interno. Esta cantidad de calcio se denomina “calcio endógeno” (CaE), y puede asimismo ser absorbido, igual que el de cualquier otro origen.
En consecuencia, cada día, el medio interno recibe una masa “CaA” y pierde una masa “CaE” de calcio, resultando de ello un balance denominado “absorción neta de calcio” (ANCa), que puede ser positivo, nulo o negativo según los valores que asuman CaA y CaE.
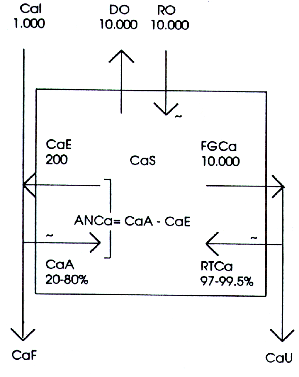
Los valores positivos y negativos de ANCa constituyen, en consecuencia, perturbadores del sistema, porque representan masas de calcio que entran o salen al o del medio interno, y tienden a cambiar su concentración cálcica. La Figura 2, que simplifica aún más el esquema de la Figura 1, muestra algunas referencias numéricas para hacer más claro este concepto a los fines prácticos.
Normalmente, el Cal puede alcanzar los 1000 miligramos diarios (mg/d). El CaA es una fracción porcentual del Cal, más o menos constante para cada persona durante períodos cortos, pero diferente de un individuo al otro, entre 20 y 80%.
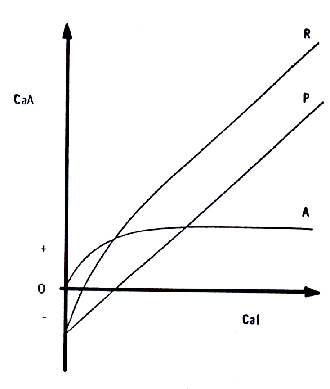
La razón de este amplio rango de variación estriba en el trabajo combinado de dos diferentes mecanismos absortivos para el ingreso del calcio al medio interno por esta vía (Figura 3):
- Uno, pasivo (P), por simple difusión, por el cual lo cantidad absorbida crece linealmente con la cantidad a absorber, y cuya importancia aumenta distalmente, siendo grande en el íleon.
- El otro, activo (A), energético-dependiente. saturable, cuya eficiencia (máxima en el duodeno), depende de lo actividad de las hormonas reguladoras, en forma directa respecto de la falta de calcio en el organismo.
La resultante (R) muestra que, al menos para ingestas cálcicas normales o grandes, el CaA sigue casi linealmente al Cal considerando ambos mecanismos en conjunto (9,17,22).
Figura 2
Figura 3
Figura 4
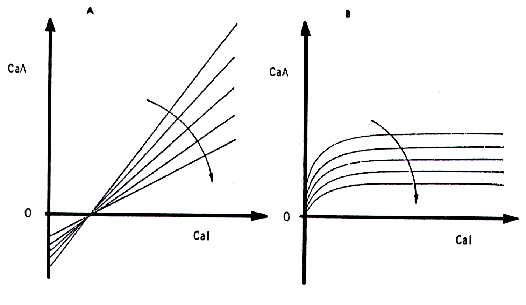
Además, la edad del sujeto está inversamente relacionada con la eficiencia absortiva de cada mecanismo, en la forma en que lo indican las flechas de la Figura 4, a y b.
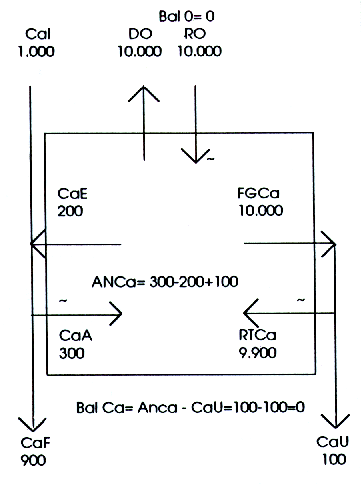
El CaE es normalmente una cantidad casi fija (cerca de 200 mg/d) debido a que depende de la CaS y de la presión sanguínea, ambas variables bien controladas por el organismo (se ha descubierto hace algunos años que la intoxicación con galactosa (8) o con glucocorticoides (6,10,20,27) son las dos únicas condiciones en las cuales el vector CaE puede ser considerablemente aumentado). Normalmente, para un valor de CaA de, por ejemplo 30% del Cal, su monto será de 300 mg/d, y la ANCa (=CaA, esto es 300-200 mg/d) será 100 mg/d positivo (Figura 5).
Figura 5
La importancia del subsistema intestinal como perturbador del sistema regulador deviene más clara si se considera:
a) que el valor CaA puede ser mucho más alto (o mucho más bajo) que el dado
30%;
b) que es posible ingerir algo más (o mucho menos) de 1000 mg/d de calcio;
c) que la CaS se aproxima normalmente o sólo 10 ± 1 mg/dl, y
d) que la cantidad total de sangre del cuerpo humano asciende en promedio o sólo
cinco litros.
En consecuencia, normalmente, la perturbación derivada del trabajo intestinal (ANCa) representa alrededor de 1/5, o 20% (valor positivo) del total de calcio presente en la sangre.
EL SUBSISTEMA URINARIO
La cantidad de calcio que sale del organismo por la vía urinaria (calcio urinario. CaU) es el resultado de dos diferentes mecanismos:
- La filtración del calcio sanguíneo a través de las membranas especiales (glomérulos) de cada unidad funcional del riñón (filtrado glomerular de calcio, FGCa), que asciende aproximadamente a 10.000 mg/d, valor casi fijo debido a que depende, igual que el CaE, de la CaS y de la presión sanguínea, ambas variables bien controladas por el organismo.
- La reabsorción de calcio filtrado, a cargo de los túbulos renales (reabsorción tubular de calcio, PTCa), que reingresa al medio interno el 99% de la FGCa, o sea, aproximadamente, 9.900 mg/d. Este valor porcentual puede fluctuar algo (de 97 a 99,5%) a causa de la acción de hormonas reguladoras cuya actividad depende, igual que paro el caso de la absorción intestinal, de la necesidad de calcio del organismo. En consecuencia, el CaU aproxima los 100 mg/d (Figura 5).
Notablemente, esta masa de calcio equivale aproximadamente al valor normal positivo de la ANCa, que según se vio, podría actuar como perturbador más o menos importante para el sistema regulador de la CaS. El sistema urinario, entonces, actúo como un subsistema regulador, porque compensa prácticamente toda la perturbación normalmente provocada por la absorción intestinal de calcio (ANCa), anulando el balance cálcico del cuerpo (BalCa).
Su eficiencia, sin embargo, no es considerada muy alta, porque el rango de su variabilidad es relativamente pequeño durante períodos breves. Por esta razón, la perturbación provocada por el intestino no podría ser anulada completamente por el subsistema urinario cuando su valor es muy alto. Además, si el valor ANCa es bajo (alrededor de 0 o negativo), como el subsistema urinario, puede solamente dar balances negativos de calcio “per se”, razonablemente, éste no solo no jugaría ya en este caso, como un subsistema regulador más o menos bueno, sino que también podría constituir un segundo (indeseable) perturbador para todo el sistema.
EL ESQUELETO
El subsistema esquelético es, en cierto sentido, el más importante de los tres, pese al hecho de no poseer cavidad interior conductora ni orificios comunicantes con el exterior.
Cada hueso posee, además de células (que son poco abundantes, pero activas) un material intercelular duro, que le confiere al tejido óseo sus propiedades biomecánicas (1,3,7,11,12,13,14,15,16), y que contiene abundante calcio. Los razones de la importancia del subsistema esquelético son las siguientes:
a) El esqueleto entero es un verdadero banco de calcio. Contiene no menos de un millón de mg (o sea, un kg) de calcio, o el 99% del total calcio del organismo adulto, combinado con fosfato y con otros aniones en los cristales del material óseo.
b) Este calcio está (no todo, pero si gran parte) disponible para un intercambio más o menos rápido con el medio interno que rodea los cristales y las células óseas.
c) Cada día. 10.000 mg de calcio abandonan los cristales debido al trabajo metabólico de las células óseas, mediante un mecanismo activo denominado “reabsorción ósea” (RO), propio del tejido óseo vivo, y controlable por ciertas hormonas, cuya actividad está relacionada con las necesidades de calcio del organismo (Figura 5).
d) Lo misma masa de calcio (10.000 mg/d) se deposita sobre la superficie de los cristales óseos a favor de un mecanismo pasivo, físico, denominado “deposición ósea” (DO), relativamente constante y no controlable por mecanismos regulatorios hormonales, de forma que el tejido recibe diariamente la misma cantidad de calcio, sea que esté muerto o vivo. Cada médico sabe que los fragmentos óseos que yacen aislados del resto del hueso tras una fractura se transforman en trozos más duros, más opacos a los rayos X, más densos, y más ricos en calcio; este es el resultado de la falta del mecanismo activo propio del hueso vivo, que extrae el calcio del material óseo, en tanto la deposición física del material continúa como en el estado normal) (Figura 5).
e) Así, el movimiento total del calcio óseo (entrada y salida) asciende aproximadamente a 20.000 mg/d, que devienen de la suma de 10.000 mg/d de DO más 10.000 de RO. Esta masa teórica de calcio se denomina “recambio» o “turnover» óseo, en alusión a la renovación resultante del proceso según pasa el tiempo.
Notablemente, pese a la importancia del subsistema esquelético derivada de contener e intercambiar tanto calcio con las restantes partes del sistema regulador, su participación en la regulación rápida de la CaS no es tan grande. Esta aparente paradoja se explica principalmente porque el subsistema urinario es generalmente suficiente para anular rápidamente los resultados de la perturbación intestinal. De esta forma, el balance cálcico óseo (Bal O) -que razonablemente debe igualar el BalCa de todo el cuerpo (Figura 5)- se aproxima a cero cada día en el adulto. Este no es el caso, sin embargo, en situaciones como las dos siguientes:
1. El niño normal y sano
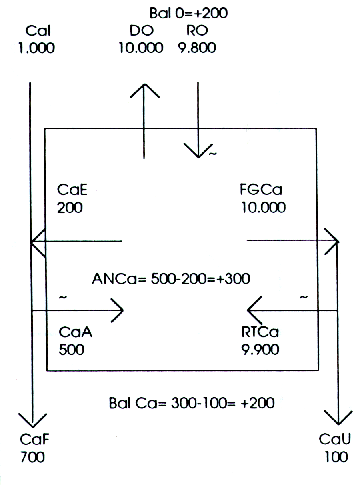
El niño usualmente ingiere mucha cantidad de lácteos, tal que su Cal asciende fácilmente a 1.000 mg/d en muchos casos (Figura 6). Su CaA es generalmente alto, debido a una mejor eficacia absortiva (Figura 4). Podemos suponer sin riesgo de error que se aproximaría un 50% del Cal, o sea, 500 mg/d. Supuestamente, el CaE (valor constante) se aproximaría coma máximo a los 200 mg/d. En consecuencia la perturbación originada en el intestino (ANCa) será de 300 mg/d, resultado de la suma algebraica de 500 mg/d de Cal más 200 mg/d (negativos) de CaE.
Como el subsistema urinario difícilmente eliminaría más de 100 mg/d en el niño, se concluye que 300-100= 200 mg diarios de calcio quedarían sin compensar si ningún otro subsistema contribuyese a la regulación de la CaS, y ésta tendería a aumentar. En este caso, la compensación corre a cargo del esqueleto.
A las células óseas no les es posible modificar la deposición física de calcio sobre los cristales, pero, obedeciendo mensajes de sus reguladores endocrinos, reducen su trabajo metabólico y su resultante, es decir, la RO, tanto como sea necesario; por ejemplo, 200 mg/d, lo que resulta en RO= 9.800 mg/d, en vez de 10.000 mg/d como indica el esquema normal para el adulto. De esta forma, el Bat O ya no es nulo sino positivo (esto es, negativo para el medio interno). La CaS ya no tendrá razones para cambiar, y el esqueleto enriquece su contenido mineral, pudiendo aumentar su masa sin modificar sus propiedades intrínsecas. En resumen: el niño crece normalmente.
Figura 6
2. El anciano normal pero caprichoso
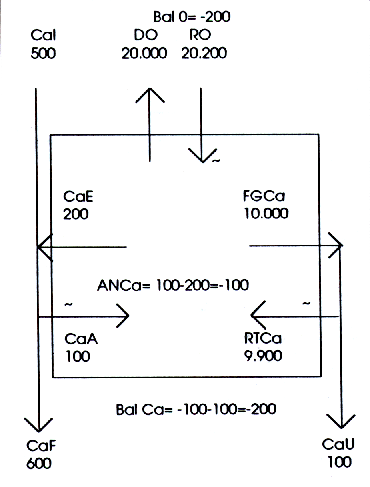
Esta clase relativamente abundante de sujeto, contrariamente a lo que ocurre en el niño, suele rechazar la ingesta de productos lácteos, además de poseer mecanismos absortivos deficientes.
Podemos tranquilamente suponer que su Cal no sobrepasa los 500 mg/d, y que su eficiencia absortiva es tan pobre como del 20% del Cal, o sea, que el CaA será de solo 100 mg/d (Figura 7).
Siendo el CaE constantemente aproximado a 200 mg/d, la perturbación intestinal (ANCa) resultará negativa en -100 mg/d, resultante de la suma algebraica de 100 mg entrantes al medio interno más 200 mg salientes.
El subsistema urinario, por su parte, eliminará poco más de 100 mg/d de calcio y, como hiciéramos notar anteriormente, podrá actuar en efecto como un perturbador adicional del sistema regulador de la CaS.
El BalCa total del organismo resultará así de aproximadamente -200 mg/d, y la CaS tenderá a disminuir, salvo que algún otro subsistema regulador participe.
Este subsistema regulador es precisamente el esqueleto, que contrariamente a lo que, ocurre en el niño, aumenta su RO, obedeciendo los mensajes de sus reguladores endocrinos, llevándola a 10.200 mg/d, en vez de 10.000.
Este hecho induce una elevación de la CaS, que en consecuencia no tenderá ya a cambiar, pero el esqueleto perderá los 200 mg correspondientes de calcio.
Los dos ejemplos analizados brindan una excelente ocasión para comprender la clase de participación que cabe al esqueleto en el sistema regulador de la CaS; aunque tal participación casi no tiene lugar si otros subsistemas dejan las cosas en orden, su importancia crece mucho como subsistema regulador cuando la perturbación de la variable regulada (CaS) es suficientemente grande.
De este modo, el esqueleto parece conducirse como un “banco central”, que compensa tanto los buenos como los malos negocios de sus clientes (los subsistemas orgánicos) mediante préstamos (+RO) o sistemas de ahorro (-RO), cuidando al mismo tiempo del volumen de dinero circulante (la CaS).
Figura 7
MOVIMIENTO del FOSFATO
Hasta ahora sólo hemos considerado la regulación de la CaS, como si ésta fuera la única variable regulada del metabolismo fosfocálcico.
Esto es adecuado a los fines didácticos, pero no es estrictamente correcto.
La CaS es, en efecto, la variable regulada más importante del metabolismo fosfocálcio, pero también la concentración de fosfato en la sangre (fosfatemia, PS), equilibrada con la concentración de fosfato del medio interno, es objetivo de algunos mecanismos (25), que estudiaremos seguidamente.
Los fosfatos (principalmente aniones diácidos, monoácidos o neutros) presentan alta afinidad por el catión calcio, de forma que se puede suponer que ambos minerales siguen las mismas vías en el metabolismo.
En efecto, casi todo lo que comentamos sobre el calcio es también aplicable al fosfato, especialmente la absorción y la excreción por el intestino, la DO y la RO, y la filtración renal (no la reabsorción). Pero algunos aspectos del movimiento del fosfato no son congruentes con los aspectos homólogos del movimiento del calcio.
Estos son:
a) Fosfato y células: el fosfato, contrariamente al calcio, abunda en el interior de las células, en donde se presenta como el anión mas concentrado.
b) Fosfatemia como variable regulada: la PS no es una variable tan precisamente regulada como la CaS (quizá la anterior circunstancia (a) sea importante para este hecho). La PS asciende a 3,7 ± 1,0 mg/dl, o sea, muestra una variabilidad comparablemente mayor que la de la CaS (cerca de 20%, vs 10%).
c) El riñón reabsorbe fosfatos mucho menos eficientemente que el calcio. Lo reabsorción tubular de fosfato (RTP) asciende normalmente a solo el 80% y por tanto puede fluctuar mucho más que la RTCa, entre 50 y 95%.
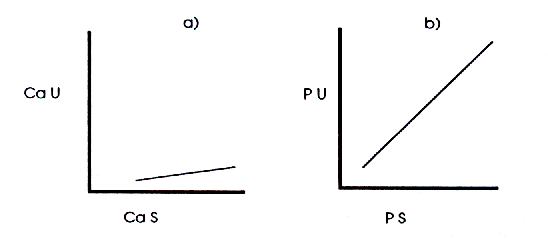
d) La excreción urinaria de fosfato (fosfaturia, PU) fluctúa también mucho por la anterior razón (c), e influye mucho más sobre la PS que la CaU sobre la CaS. Correlativamente, la PS influye sobre la PU mucho más que la CaS sobre la CaU (Figura 8). Durante los estudios clínicos, se deben prefijar tanto el Cal como el Pl previamente a la ejecución de análisis de orina para determinar respectivamente la CaU y la PU, pero la segunda recomendación (fijar el Pl) es más importante que la primera (fijar el Cal) para minimizar la variancia de los resultados.
Figura 8
e) Una de las hormonas reguladoras que estudiaremos después, la porathormona (PTH), modifica inversamente la RTP con relación a la RTCa. Este es el único fenómeno de esta especie que veremos en todo el estudio del metabolismo fosfocálcico.
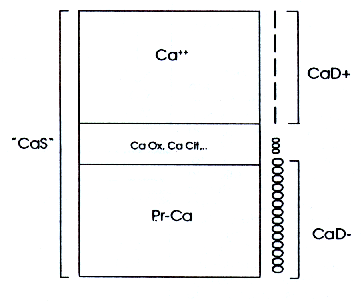
f) La CaS comprende realmente tres componentes diferentes (Figura 9):
- El calcio ligado a las proteínas sanguíneas, que asciende a casi el 50% de la CaS total. Este no difunde a través de las membranas renales (CaD-), y sus variaciones no influyen la secreción de los reguladores hormonales.
- El calcio ligado a los aniones “débiles” de la sangre en forma de compuestos estables (ejemplo: citrato, oxalato), que es cuantitativamente poco importante (cerca del 5% de la CaS total). Este si filtra por los glomérulos (CaD=), pero sus variaciones no influyen la secreción de los reguladores hormonales.
- El catión calcio (Ca++), que asciende a poco menos del 50% de a CaS total. Este filtra (CaD+), y además sus variaciones influyen fuertemente las secreción de algunos reguladores hormonales.
Figura 9
Cuando los bioquímicos analizan la “CaS”, realmente miden la CaS total, no indicando las diversas fracciones, porque la determinación del catión es muy costosa.
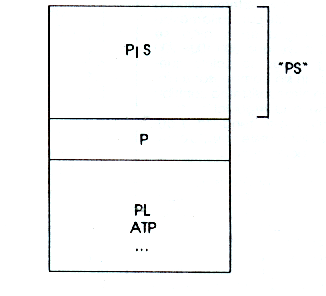
La PS, diversamente, comprende también tres componentes, pero estos no son perfectamente comparables con los tres componentes de la CaS (Figura 10):
- El fósforo ligado a grandes moléculas orgánicas (fosfolípidos, ATP, etc.).
- El fósforo ligado en moléculas mas pequeñas, poco disociables.
- El fósforo como mineral simple. Esta fracción es la única que influye la secreción de un regulador hormonal (el calciferol), y no es tan importante como la CaS para la regulación del metabolismo fosfocálcico, como veremos luego.
- Cuando el bioquímico analiza la “PS”, realmente mide solo la tercera fracción (mineral)+, y debe informar el resultado como el “fosfato mineral del suero”. En relación con casi todos los otros aspectos metabólicos, el movimiento del fosfato es congruente con el del calcio; por tanto, no nos referimos a él.
Figura 10
PARTICIPACIÓN del MAGNESIO
El magnesio es también un mineral importante para el organismo y para al metabolismo fosfocálcio (19). Es necesario en cantidades mucho menores que el calcio o al fosfato, pero resulta crítico para la acción de muchas enzimas metabólicas y para algunos mecanismos secretorios. El movimiento del magnesio en al organismo semeja al del calcio o al del fosfato, pero existen importantes diferencias respecto de sus interrelaciones con las hormonas reguladoras del mecanismo fosfocálcico.
Las células contienen relativamente granes cantidades de magnesio, que es su principal catón bivalente.
Los cristales óseos también contienen magnesio en su estructura. En la sangre, la concentración de magnesio (megnesemia, MgS) es de aproximadamente 2,0 mg/dl, y no es modificable fácilmente, porque el magnesio en la sangre está siempre en activo intercambio con el contenido en las células y en el mineral óseo, que actúa como reserva para el organismo.
El mecanismo regulatorio de la MgS no está todavía bien comprendido. La PTH aumenta la reabsorción tubular de magnesio (RTMg), y se requiere también una cierta cantidad de MgS para que la PTH actúe y/o sea segregada (18, 26), pero esta clase de interpelación no es congruente con el concepto de mecanismo de control retroalimentado.
De cualquier modo, la MgS es una variable bien controlada, y este hecho es importante para el organismo, porque la relación de concentraciones (en Mo 1/1):
NaS . KS
CaS . MgS
rige la contractibilidad muscular (aunque no para el miocardio), que es muy sensible a la disminución de la CaS y/o de la MgS. Cuando la MgS desciende mucho, aparece tetania igual que durante la hipocalcemia, y la única manera de curar al paciente que la sufre es darle tanto magnesio como necesita para normalizar su MgS, o sea, para restaurar su reserva de este mineral (21).
La carencia o la ingesta excesiva de magnesio, no influyen directamente sobre las propiedades del hueso, y pueden actuar indirectamente sobre el metabolismo fosfocálcico mediante sus efectos sobre la secreción paratiroidea (3,15).
Las relaciones entre el hueso y las demás hormonas no son importantes para comprender los aspectos generales del metabolismo fosfocálcico, y no nos preocuparemos de ellas aquí.
Las relaciones de lo expuesto con el ejercicio y el deporte, se desarrollarán en los próximos artículos, tratándose a posteriori, las implicancias del calcio, fósforo y magnesio en aspectos tan importantes como la contracción muscular y la fatiga, o como la relación entre osteoporosis y ejercicio.
REFERENCIAS
1. Aubert PP, Milhaud DD (1960). Methode de mesure des principales voies du metabolisme calcique chez ihomme. Biochm Biophys. Acta Amst. 39: 122-139
2. Audisio EO, Tessaro RD, Ferretti JL, et al (1982). Efecto de la depleción magnésica sobre variables biofísicas óseas y sobre la fosfatasemia alcalina l-fenilalanina-sensible en la rata. . Medicina (BA) 42: 897-898
3. Avioli LB (1972). Intestinal absorption of calcium. Arch Int Med, 129: 345-355
4. Collins EJ, Garrett ER, Johnston RL (1962). Effect of adrenal steroids on radiocalcium metabolism in dogs. Metabolism 11: 716-726
5. Ferretti JLI, Delgado CJ, Gherseirch S, Augburger S (1987). Biochemical description of corticoid osteoporosis in rat long bones. Calcium Regulation and Bove Metabolism. Basic and Clinical Aspects Vol 9 Excerpta Medica, Amsterdam
6. Ferretti JL, Locatto Me, Savino D, Puche RC (1974). The effect of galactose on bone metabolism. Calcif Tissue Res, 14: 169-175
7. Ferretti JL, Audisio EO, Tessaro RD, Galassi CD, Masoni AM, Puche RC (1984). Effect of cholecalciferol and 1,25 (HO) 2-cholecalciferol on the mechanical properties of the femurs of rachitic chicks fed a P-deficient diet. Nutr Rep internat 29: 213-21
8. Ferretti JL (1986). Papel del calcio en la contractilidad miocárdica. En: Fisiopatología de la insuficiencia cardíaca, de A Guimpel. Departamento de Publicaciones de la Universidad Nacional de Rosario, en prensa
9. Krawitt EL, Schedl HP (1968). In vivo calcium transport by rat small intestine. AM J Physiol 214: 232-236
10. Mayer GP (1975). Effect of calcium and magnesium on parathyroid secretion in claves. In: Calcium Regulating Hormones, pp 122-123. Excerpta Medica, Amsterdam
11. Mcintyre l (1963). An outline of magnesium metabolism in health and disease. A review. J Chron Dis 16: 201-215
12. Piazza MV, Deergasso FD, Ferretti JL (1979). Implante de paratiroides en humanos. Rev Arg Cirug, 38: 139-141
13. Puche RC, Romano MC, Locatto ME, Ferretti JL (1973). The effect of insuline on bone resorption. Calcif Tissue Res 12: 8-15
14. Rasmussen H, Bordier Ph (1974). The physiological and cellular basis of metabolic bone disease. Williams & Wilkins, Baltimore
15. Sherwood LM, Hanley DA, takasuki F, Birnbauer ME, Schneider AB, Welis SA Jr (1978). Regulation of parathyroid hormone. In: Endocrinology of calcium metabolism (Poc 6th Parathyroid Conference, Copp DH, Talmage Veds), pp 301-317. Excerpta Medica, Amsterdam
16. Wajchenberg BL, Pereira VG, Kieffer J, Rusic S (1969). Effect of dexamethasone on vcalcium metabolism and 47 Ca kinetics in normal subjects. Acta Endocrinol (kbh) 61: 173-192
Aumento inducido por el ejercicio en el factor neurotrófico derivado del cerebro (BDNF) en personas con esclerosis múltiple: Una revisión sistemática y metaanálisis de ensayos de intervención de ejercicio
El papel del Factor Neurotrófico Derivado del Cerebro (BDNF) en la esclerosis múltiple (EM) ha...
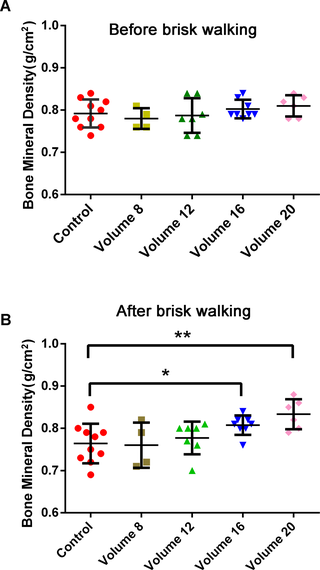
El volumen de caminata rápida es el factor clave para la mejora de la DMO en mujeres en premenopausia
Brisk Walking y Densidad Mineral Ósea: Clave para las Mujeres Premenopáusicas La osteoporosis es...
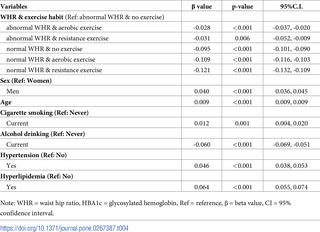
Efectos del ejercicio aeróbico y de resistencia en las concentraciones de hemoglobina glucosilada (HbA1c) en individuos taiwaneses no diabéticos según la relación cintura-cadera
El estudio analiza la relación entre los niveles de hemoglobina glucosilada (HbA1c) y la práctica...
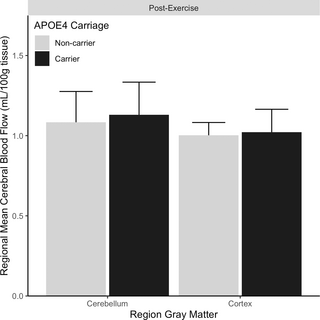
Riesgo de demencia y respuesta dinámica al ejercicio: Un ensayo clínico no randomizado
Resumen El ejercicio físico ha mostrado ser un aliado clave para la salud cerebral y la cognición...
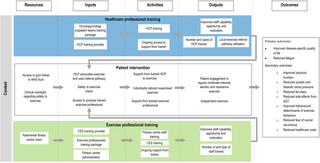
Evaluación del proceso para el ensayo controlado aleatorizado STAMINA: Un protocolo
Evaluación del Proceso del Ensayo Controlado Aleatorizado STAMINA Introducción El ensayo STAMINA...