Resumen
A pesar de la evidencia acumulada de que el entrenamiento con restricción del flujo sanguíneo (BFR) promueve la hipertrofia muscular y la ganancia de fuerza, los mecanismos neurofisiológicos subyacentes rara vez se han explorado. El objetivo principal de este estudio es investigar las características de la actividad de la corteza cerebral durante el entrenamiento BFR bajo diferentes intensidades de presión. 24 hombres participaron en un ejercicio de sentadilla al 30% de 1RM, los cambios en la concentración de hemoglobina oxigenada (HbO) en la corteza motora primaria (M1), la corteza premotora (PMC), el área motora suplementaria (SMA) y la corteza prefrontal dorsolateral (DLPFC), se midieron mediante fNIRS. Los resultados mostraron que la HbO aumentó de 0 mmHg (sin BFR) a 250 mmHg, pero cayó bruscamente bajo una intensidad de presión de 350 mmHg. Además, la HbO y la conectividad funcional fueron mayores en M1 y PMC-SMA que en DLPFC. Además, el efecto de interacción significativo entre la intensidad de la presión y el ROI para la HbO reveló que la regulación de la corteza cerebral durante el entrenamiento BFR fue más pronunciada en M1 y PMC-SMA que en DLPFC. En conclusión, el entrenamiento de resistencia de baja carga con BFR desencadena respuestas agudas en la corteza cerebral, y la intensidad de presión moderada logra beneficios neuronales óptimos al mejorar la activación cortical. M1 y PMC-SMA juegan papeles cruciales durante el entrenamiento BFR a través de la activación y la regulación de la conectividad funcional.
Introducción
El entrenamiento con restricción del flujo sanguíneo (BFR) generalmente implica el uso de manguitos neumáticos colocados alrededor de las extremidades para limitar la entrada de sangre a los músculos durante el ejercicio (1). Se ha demostrado que promueve la hipertrofia muscular y el aumento de fuerza entre personas con distintas capacidades atléticas y cargas de ejercicio bajas (2–4). Si bien la BFR se ha combinado con varios tipos de ejercicio, las investigaciones indican que las ganancias musculares más sustanciales se obtienen con el entrenamiento de resistencia (RT) por debajo del 20%-40% de la repetición máxima (1RM) o la contracción voluntaria máxima (MVC) (5). Con la creciente popularidad del BFR en el ámbito del entrenamiento, muchos investigadores han comenzado a investigar sus mecanismos potenciales, como el estrés metabólico, la hinchazón celular, la regulación hormonal y otros mecanismos a nivel celular y molecular (6–8). Sorprendentemente, aunque la regulación neuronal ha contribuido significativamente a la hipertrofia muscular y al aumento de fuerza (9–12), los estudios sobre el entrenamiento BFR en esta área siguen siendo limitados. Sin embargo, ya hay evidencia que sugiere la regulación de los sistemas neuronales durante el entrenamiento BFR. Por ejemplo, los investigadores han descubierto que el entrenamiento BFR afectaba la señal electromiográfica, que respalda la respuesta aguda de los sistemas neuromusculares (13,14). Además, los estudios han demostrado que la hipertrofia muscular y la ganancia de fuerza pueden transferirse de los músculos expuestos a BFR a los músculos no expuestos a BFR (15,16). Además, Sugimoto et al.(17) descubrieron que la combinación de BFR con caminatas mejoraba el desempeño de los participantes en tareas cognitivas. Sin embargo, los estudios que emplean electromiografía tienen limitaciones a la hora de explorar el proceso de regulación neuronal (18), el efecto de transferencia en la hipertrofia muscular y la ganancia de fuerza, así como la mejora de la cognición con el entrenamiento BFR solo proporcionan evidencia indirecta. Para obtener una comprensión más profunda de los mecanismos neurofisiológicos asociados con el entrenamiento BFR, es crucial proporcionar evidencia sólida de las características de la actividad dentro del sistema nervioso central (SNC), como la activación y la conectividad funcional (CF) de la corteza cerebral. Esos índices no solo sirven como excelentes ventanas para explorar el patrón de respuesta de la corteza cerebral, sino que también se ha confirmado que experimentan cambios adaptativos con el entrenamiento de resistencia.19).
La evidencia actual sobre la respuesta cortical inducida por el entrenamiento BFR es limitada. Un estudio previo de Morita et al. (20) informaron de una mayor activación en la corteza prefrontal durante el entrenamiento BFR en comparación con el entrenamiento sin BFR. De manera similar, Brandner et al. (21) evaluaron los cambios en los potenciales evocados motores (MEP) mediante estimulación magnética transcraneal, revelando amplitudes de MEP más altas después del entrenamiento BFR. Sin embargo, estos estudios adolecían de un tamaño de muestra notablemente pequeño, y el uso de MEP para medir la excitabilidad cortical conlleva limitaciones inherentes (22). Además, el efecto dosis-respuesta de la intensidad de la presión, una variable clave que influye en la eficacia del entrenamiento BFR (2,5,23), sobre la actividad cortical aún no se ha examinado. Como resultado, la evidencia que respalda la regulación cortical durante el entrenamiento BFR sigue siendo débil e incompleta. Además, existe la posibilidad de que los aumentos en la activación cortical del estudio anterior (20) son consecuencias pasivas de la distribución alterada de la sangre y del aumento del flujo sanguíneo cerebral durante el entrenamiento BFR, en lugar de una regulación activa del SNC. Sin embargo, esta hipótesis aún debe probarse.
La espectroscopia funcional de infrarrojo cercano (fNIRS) se ha utilizado ampliamente para examinar la actividad cerebral. Es muy adecuada para monitorear la respuesta cortical durante situaciones de ejercicio.24). Esta técnica nos permite evaluar las características de la actividad de la corteza cerebral durante el entrenamiento BFR examinando los cambios de concentración de hemoglobina oxigenada (HbO) y hemoglobina desoxigenada (HHb). Es importante mencionar que elegimos HbO como el indicador principal para evaluar la activación cortical y la conectividad funcional en este estudio. Esto se debe a la relación señal-ruido superior de la HbO, la confiabilidad, la mayor sensibilidad a los cambios del flujo sanguíneo cortical y una contribución más significativa a la señal de oxígeno general en comparación con la HHb (25–28). Además, las regiones de interés en las que nos centramos en esta investigación incluyen la corteza motora primaria (M1), la corteza premotora (CPM), el área motora suplementaria (AMS) y la corteza prefrontal dorsolateral (CPDL). Estas regiones no solo desempeñan papeles importantes en la planificación y ejecución motora (29–31) pero también son cruciales para facilitar la inducción de adaptaciones del SNC resultantes del ejercicio (10,32).
Por lo tanto, el objetivo principal de este estudio es proporcionar evidencia estable y completa sobre la respuesta cortical durante el entrenamiento BFR. Específicamente, pretendemos combinar el ejercicio de sentadilla al 30% de 1RM con BFR bajo diferentes intensidades de presión (150 mmHg, 250 mmHg, 350 mmHg y 0 mmHg o sin BFR como condición de control) para investigar la activación cortical y FC en M1, PMC-SMA, DLPFC a través de fNIRS. La primera hipótesis es que la intensidad de la presión afecta la respuesta cortical. Además, inferimos que la activación y la fuerza de FC mejorarían con la intensidad de la presión para mejorar la producción de fuerza muscular (19, 33,34). Esto se debe a que el aumento del estrés metabólico con BFR restringe la capacidad del músculo (6,34), y el SNC puede compensar la pérdida de fuerza muscular bajo BFR mejorando el reclutamiento de unidades motoras y mejorando la frecuencia de descarga de impulsos neuronales.35), lo que resulta en una mayor activación. Además, teniendo en cuenta los cambios en la HbO cortical durante el entrenamiento BFR, pueden resultar de una distribución sanguínea alterada y un mayor flujo sanguíneo cerebral (36,37), en lugar de la regulación activa del SNC, proponemos la segunda hipótesis de que la influencia de la intensidad de la presión en la activación cortical está moderada por las regiones de interés (ROI). Esto se basa en el supuesto de que si las ROI en nuestro estudio desempeñan un papel activo en la regulación del SNC durante el entrenamiento BFR, detectaremos un efecto de interacción entre la intensidad de la presión y las ROI con respecto a la activación cortical. Por el contrario, si los cambios en la activación cortical son resultado de variaciones en el flujo sanguíneo cerebral durante el entrenamiento BFR, los efectos reguladores de la intensidad de la presión en diferentes ROI deberían ser consistentes.
Métodos
Participantes
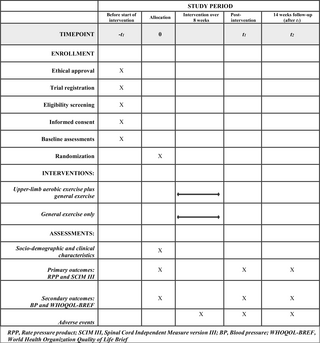
En este estudio participaron 24 hombres (edad, 20,08 ± 0,93 años; altura, 179 ± 5 cm; peso, 73,63 ± 10,53 kg; 1RM, 133,33 ± 15,37 kg). La determinación del tamaño de la muestra se basó en el análisis de potencia previa en G*Power y MPower (38,39). Se pueden encontrar más detalles sobre el análisis de potencia previo en Apéndice S1. Para reducir el riesgo potencial de lesiones durante el entrenamiento de resistencia (RT), todos los participantes tenían al menos 1 año de experiencia en entrenamiento de sentadillas (3,52 ± 1,25 años). Los criterios de exclusión incluyeron trastornos neurológicos o psicológicos (depresión, autismo, manía, esquizofrenia, epilepsia, accidente cerebrovascular, etc.), el uso de medicamentos que afectan el SNC, el consumo de cafeína o alcohol dentro de las 24 horas anteriores al experimento, lesiones agudas o crónicas relacionadas con el ejercicio, así como enfermedades cardiovasculares. El período de reclutamiento comenzó el 10 de junio de 2023 y finalizó el 30 de noviembre de 2023. Se obtuvo el consentimiento informado por escrito de todos los participantes antes del estudio, y el Comité de Ética de la Universidad de Deportes de Wuhan otorgó la aprobación ética para este experimento (Aprobación No. 2023050).
Material y tarea del experimento
Las herramientas utilizadas en este estudio incluyeron un soporte para sentadillas, un sistema de imágenes de infrarrojo cercano (NIRx-sport2, NIRx Medizintechnik GmbH, Berlín, Alemania) y manguitos neumáticos con un ancho de 7 cm (B-Strong, EE. UU.). La tarea se llevó a cabo con E-prime 2.0 (Psychology Software Tools, Pittsburgh, EE. UU.). Todos los experimentos se llevaron a cabo en un laboratorio aislado de la luz y el ruido externos. En concreto, a los participantes se les presentó inicialmente una señal que indicaba la preparación para una sentadilla. Posteriormente, los participantes realizaron sentadillas siguiendo las señales que se mostraban en la pantalla. Después de completar cada sentadilla, los participantes descargaron la barra y mantuvieron una postura estática de pie durante un intervalo hasta que apareció la señal para la siguiente preparación de sentadilla, como se ilustra en la figura 1. Figura 1.
Las personas que aparecen en esta fotografía han dado su consentimiento informado por escrito (como se describe en el formulario de consentimiento de PLOS) para publicar los detalles de estos casos.
El experimento formal se dividió en 4 bloques, cada uno de los cuales constaba de 20 ensayos, con 2-3 minutos de descanso intercalados entre bloques. La intensidad de la RFS se controló utilizando manguitos neumáticos a 4 intensidades de presión (0 mmHg, 150 mmHg, 250 mmHg y 350 mmHg) en estos 4 bloques. Los manguitos se colocaron en un tercio de la parte superior de los muslos de los participantes de forma bilateral durante cada bloque, sin oclusión durante los períodos de descanso entre bloques, como se muestra en la figura 1. Figura 2Los bloques se presentaron en un orden pseudoaleatorio para minimizar el posible impacto del orden de los bloques en los resultados experimentales. Para determinar la resistencia externa de la sentadilla en el entrenamiento BFR, todos los participantes se sometieron a una prueba de 1RM 1-2 días antes del experimento. La prueba comenzó con un calentamiento, seguido de la prueba de sentadilla con el peso inicial establecido en el 70% de la 1RM autoestimada del participante. Después de completar la prueba de sentadilla de 1RM, los participantes realizaron estiramientos estáticos durante 3-5 minutos.
Grabación fNIRS
Se utilizó el NIRx-Sport2 (onda continua) con longitudes de onda de 760 y 850 nm para registrar los cambios en la HbO cortical a una frecuencia de muestreo de 10,2 Hz. Este sistema tiene 8 fuentes de luz y 7 detectores, que forman 22 canales (como se ilustra en Figura 3). Estos canales cubrieron principalmente M1, PMC-SMA y DLPFC. La ubicación de las fuentes de luz y los detectores se determinó mediante el decisor de ubicación de los optodos fNIRS (40). El atlas cerebral hacía referencia a las regiones cerebrales de Brodmann y las coordenadas de las fuentes de luz y los detectores se basaban en el sistema internacional 10-10.
BrainnetViewer visualizó el diseño del canal con la plantilla cerebral suavizada de Colin (41). Las coordenadas de los nodos correspondían a las posiciones de las fuentes de luz (rojo) y de los detectores (azul), mientras que los bordes representaban los 22 canales. El término…