Resumen
Antecedentes
Los síntomas vasomotores (VMS) son comunes alrededor de la menopausia. La terapia hormonal menopáusica es el tratamiento más eficaz para el VMS. El ejercicio físico se ha propuesto como un tratamiento alternativo ya que anteriormente se había descubierto que las mujeres físicamente activas experimentaban menos VMS que las mujeres inactivas. En nuestro ensayo controlado aleatorio sobre entrenamiento de resistencia para tratar el VMS, los síntomas se redujeron en un 50% en el grupo de intervención en comparación con el grupo de control.
Objetivos
Proponer un mecanismo para explicar cómo el entrenamiento de resistencia redujo el VMS y evaluar si la hormona luteinizante (LH) y la hormona folículo estimulante (FSH) se vieron afectadas de acuerdo con el mecanismo propuesto.
Diseño y métodos de prueba.
Un subestudio de un ensayo controlado aleatorio en 65 mujeres posmenopáusicas con VMS y baja actividad física que fueron asignadas al azar a 15 semanas de entrenamiento de resistencia tres veces por semana (n = 33) o a un grupo de control (n = 32). Para considerar que cumplieron con la intervención, predecimos una media de dos sesiones de entrenamiento por semana. Se registró el número diario de VMS antes y durante las 15 semanas. Se extrajeron muestras de sangre para análisis de LH y FSH al inicio y después de 15 semanas.
Resultados
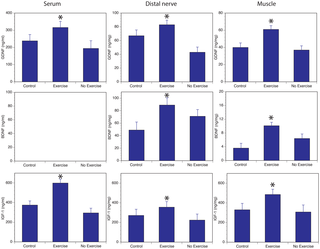
La LH disminuyó significativamente en el grupo de intervención compatible en comparación con el grupo de control (-4,0 ± 10,6 versus 2,9 ± 9,0, p = 0,028 con Mann-Whitney Ud. prueba). La FSH también disminuyó en el grupo de intervención compatible en comparación con el grupo de control, aunque no lo suficiente como para alcanzar significación estadística (-3,5 ± 16,3 versus 3,2 ± 18,2, p = 0,063 con Mann-Whitney Ud. prueba). Como se publicó anteriormente, el número de sofocos disminuyó significativamente más en el grupo de intervención que en el grupo de control, pero no hubo asociación entre el cambio en LH o FSH y el número de VMS.
Conclusiones
Proponemos que los opioides endógenos como la β-endorfina o la dinorfina producidos durante el entrenamiento de resistencia disminuyeron el VMS al estimular las neuronas KNDγ para liberar neuroquinina B al centro termorregulador hipotalámico. A través de sus efectos sobre las neuronas KNDγ, la β-endorfina también podría inhibir la GnRH y así disminuir la producción de LH y FSH. La disminución significativa de la LH en el grupo de intervención que cumplió con el tratamiento en comparación con el grupo de control estuvo de acuerdo con el mecanismo propuesto.
Antecedentes
La mayoría de las mujeres informan síntomas vasomotores (VMS), incluidos sofocos y sudores nocturnos, alrededor de la menopausia (1, 2). Los VMS tienen una duración media de 5 a 7 años, pero pueden persistir durante más de 15 años (3) y puede interferir con las actividades diurnas, el sueño y la calidad de vida (1, 2). La terapia hormonal menopáusica (MHT) es el tratamiento más eficaz para el VMS. En mujeres que inician THM antes de los 60 años o dentro de los diez años posteriores a la menopausia, se reduce la mortalidad por todas las causas (4), pero en las mujeres que inician la THM más tarde existe un mayor riesgo absoluto de enfermedad coronaria, accidente cerebrovascular, tromboembolismo venoso y demencia (5). En mujeres con antecedentes de cáncer de mama, la MHT está contraindicada (6). Por lo tanto, se necesitan alternativas a MHT para VMS.
Los estudios observacionales han informado menos VMS en mujeres posmenopáusicas físicamente activas que en mujeres posmenopáusicas sedentarias (7–9). Los estudios de intervención sobre el efecto de la actividad física en los VMS muestran resultados contradictorios, posiblemente debido al bajo cumplimiento, la baja intensidad y la alta tasa de abandono (10, 11). En nuestro ensayo controlado aleatorio sobre el efecto de 15 semanas de entrenamiento de resistencia en VMS, los síntomas se redujeron en un 50% en el grupo de intervención en comparación con el grupo de control (12). El presente subestudio tuvo como objetivo proponer un mecanismo para explicar por qué el VMS disminuyó durante el entrenamiento de fuerza. También intentamos evaluar si la hormona luteinizante (LH) y la hormona folículo estimulante (FSH) se vieron afectadas durante las 15 semanas de acuerdo con el mecanismo propuesto. Un objetivo secundario fue evaluar si existía una asociación entre la disminución de LH y FSH y la disminución de VMS.
Los VMS en mujeres posmenopáusicas probablemente se deben a una inestabilidad termorreguladora. El área preóptica (POA) del hipotálamo anterior es el área termorreguladora autónoma primaria con neuronas aferentes sensibles al calor y al frío. El POA es capaz de iniciar respuestas efectoras para mantener la temperatura central normal a pesar de los cambios en la temperatura circundante o la producción de calor endógeno (13, 14). Dentro de la zona termoneutral, los cambios menores en la temperatura central están regulados por la constricción o dilatación de las arterias periféricas, mediadas por la inervación noradrenérgica autónoma.15–17). Los cambios en la temperatura central que superan los límites de la zona termoneutral activan respuestas de disipación de calor más potentes, como la vasodilatación cutánea y la sudoración, mediadas por la neurotransmisión colinérgica.18). Esto se experimenta como una sensación repentina de calor y sudoración durante el VMS (16, 19). El péptido relacionado con el gen de la calcitonina (CGRP) puede mediar la vasodilatación colinérgica y la activación de las glándulas sudoríparas que causan el VMS (20, 21). El bloqueo de CGRP en un modelo de ratón eliminó VMS (22). Además, el CGRP sérico aumenta durante el VMS en mujeres (23).
Los estrógenos actúan estabilizando el centro termorregulador y la disminución de estrógenos alrededor de la menopausia conduce a un estrechamiento de la zona termoneutral (16, 19). En mujeres con VMS, aumentos más pequeños en la temperatura central activan las respuestas de disipación de calor en comparación con mujeres asintomáticas.24).
Los cuerpos celulares en el POA del hipotálamo secretan de forma pulsátil la hormona liberadora de gonadotropina (GnRH) en la circulación portal, lo que lleva a la hipófisis a producir y liberar gonadotropinas, la hormona luteinizante (LH) y la hormona folículo estimulante (FSH). La LH y la FSH regulan los ovarios para el crecimiento folicular, la producción de estrógenos y la ovulación. Los estrógenos ejercen una retroalimentación negativa sobre la liberación de GnRH del POA. Después de la menopausia, la amplitud y frecuencia de la secreción de LH y FSH aumentan debido a la reducción de la retroalimentación negativa de los estrógenos y la inhibina.
Algunos estudios han demostrado que VMS se sincroniza con los pulsos de LH (25, 26) pero los pulsos de LH no causan VMS ya que las mujeres con gonadotropinas suprimidas, ya sea mediante hipofisectomía o tratamiento con análogos de GnRH, todavía se ven afectadas por VMS. Los pulsos de GnRH tampoco causan VMS, ya que las mujeres con síndrome de Kallman experimentan VMS después de la abstinencia de estrógenos a pesar de su ausencia de neuronas hipotalámicas funcionales de GnRH.27, 28).
Kisspeptina/Neuroquinina B/Neuronas dinorfinas (neuronas KNDγ), originadas en el núcleo infundibular del hipotálamo (29), median la retroalimentación negativa entre los estrógenos y la GnRH a través del neuropéptido kisspeptina (30). El estrógeno afecta a las neuronas KNDγ tanto directamente mediante la unión al receptor como indirectamente al aumentar la producción de β-endorfina.31) que a su vez probablemente actúa sobre las neuronas KNDγ. La neuroquinina B y la dinorfina actúan de forma autorreguladora y afectan la secreción de kisspeptina. La dinorfina es un péptido opioide endógeno que inhibe la secreción de kisspeptina a través del receptor opioide κ.32). La neuroquinina B estimula la producción de kisspeptina a través del receptor de neuroquinina-3 (NK3R) (33, 34). Las neuronas KNDγ también participan en la termorregulación central (35, 36), proyectándose a los núcleos de disipación de calor en el POA (37) donde se libera neuroquinina B (38). Por tanto, las neuronas KNDγ constituyen un posible vínculo entre la caída de estrógenos durante la transición menopáusica y un cambio en la termorregulación.
Las neuronas KNDγ están hipertrofiadas en mujeres posmenopáusicas (39, 40). Además, la expresión genética del ARNm de dinorfina está regulada negativamente, mientras que la expresión tanto de kisspeptina como de neuroquinina B está regulada positivamente en mujeres posmenopáusicas.32, 41). Estos fenómenos son probablemente consecuencias de la abstinencia de estrógenos, ya que también se han observado en monos después de la ovariectomía y pueden revertirse con estrógenos exógenos.29). La activación de un tipo de neurona KNDγ (Kiss1ARH) en ratones desencadenó la disipación de calor con vasodilatación y una reducción de la temperatura corporal central (parecida al VMS), un efecto que se incrementó después de la ovariectomía (38).
La liberación de neuroquinina B en el centro termorregulador del POA podría causar inestabilidad termorreguladora durante el VMS en mujeres posmenopáusicas (38). La inyección de un agonista selectivo de NK3R (senktide) en POA de ratas mejoró la vasomoción de la piel y redujo la temperatura central interna (30). En humanos, la infusión intravenosa de un agonista de NK3R en mujeres posmenopáusicas indujo las características de VMS, con un aumento del flujo sanguíneo cutáneo y, curiosamente, también un pico de LH en plasma.42). Además, se ha descubierto que el tratamiento con antagonistas de NK3R reduce el VMS en mujeres (43).
Después de la menopausia, hay una disminución de la retroalimentación negativa de los estrógenos directamente sobre las neuronas KNDγ y una reducción de la producción de opioides endógenos como la dinorfina y la β-endorfina.32, 44) en el sistema nervioso central (SNC) puede explicar la regulación positiva de NKB. La β-endorfina en el SNC se ve afectada por los estrógenos mediante la activación del ERα en las neuronas hipotalámicas, lo que aumenta la producción de proopiomelanocortina, que puede escindirse en β-endorfina.45, 46). En consecuencia, la concentración de β-endorfina en el líquido cefalorraquídeo disminuye después de la menopausia (47). Un estudio piloto que utiliza agonistas κ para mejorar la actividad de dinorfina dentro de la red de neuronas KNDγ también ha mostrado resultados prometedores en el tratamiento del VMS (48).
La β-endorfina se libera tanto en el SNC como en la circulación periférica durante la activación de grandes grupos de músculos, por ejemplo, durante el entrenamiento de resistencia.49, 50). Dado que se ha sugerido que la β-endorfina estabiliza la termorregulación, propusimos que el entrenamiento de resistencia puede disminuir el VMS mediante la inducción de la producción de β-endorfina en el SNC. Con base en la información discutida anteriormente, los mecanismos propuestos detrás del VMS y el papel del entrenamiento de resistencia se resumen en Figura 2A-2D.
La amenorrea hipotalámica funcional (FHA) es un estado de hipogonadismo hipogonadotrópico causado por la pérdida de peso, el estrés o el ejercicio excesivo.51, 52). Estos factores estresantes pueden inducir la producción de β-endorfina en el SNC, que suprime la pulsatilidad de GnRH a través de efectos sobre las neuronas KNDγ. La administración del antagonista opioide naltrexona en mujeres con FHA aumentó la pulsatilidad de la LH en plasma y restableció el ciclo menstrual.53), lo que sugiere que el aumento de la señalización de opioides al menos contribuye al hipogonadismo en la FHA. A pesar de sus bajos niveles de estrógenos, las mujeres con FHA no experimentan VMS (54). La ausencia de VMS en la FHA probablemente se explica por la mayor actividad de los opioides en el hipotálamo, que, además de alterar la pulsatilidad de la GnRH, también podría estabilizar la termorregulación. Si se pudiera restaurar la señalización de los opioides en mujeres posmenopáusicas mediante un entrenamiento de resistencia similar al que se observa en los atletas con FHA, posiblemente se podría evitar el VMS.
En ratas macho, la actividad física intensiva durante seis meses redujo la expresión de los genes GnRH a través del aumento de la expresión del gen dinorfina en las neuronas KNDγ y, posteriormente, los niveles de LH en plasma disminuyeron (55). Por lo tanto, la disminución de los niveles de LH podría ser un efecto de una mayor señalización de opioides en las neuronas KNDγ. En consecuencia, la LH en plasma se redujo tanto en pacientes amenorréicos (56) y atletas de resistencia femeninas eumenorreicas (57), sugiriendo que estaba involucrado un mecanismo similar.
Como se mencionó anteriormente, hemos realizado un ECA que muestra que el VMS disminuyó en un 50% en mujeres posmenopáusicas asignadas al azar al entrenamiento de resistencia en comparación con el grupo de control (12). La hipótesis de este subestudio actual del ECA, que condujo a su objetivo, fue que la LH y la FSH disminuirían en mujeres posmenopáusicas con VMS durante 15 semanas de entrenamiento de resistencia, posiblemente debido a una mayor actividad de los opioides que afecta a las neuronas KNDγ. De ser así, esto podría sugerir una explicación de por qué los VMS se redujeron en estas mujeres. Estos mecanismos propuestos se ilustran en Figura 1D.
Diagrama de flujo según Consort que muestra el número de mujeres incluidas, aleatorizadas y seguidas en un ensayo controlado aleatorio (ECA) de 15 semanas de entrenamiento de resistencia como tratamiento para la enfermedad vasomotora…