1Programa de Pós-Graduação Stricto Sensu em Educação Física. Universidade Católica de Brasília.
2Faculdade Presidente Antônio Carlos de Uberlândia
3Colegiado de Educação Física . Universidade Federal do Vale do São Francisco .
4Centro Universitário UNIRG
5Centro Universitário do planalto de Araxá
6Faculdade Anhanguera
7Faculdade de Educação Física. Universidade de Brasília.
Resumen
INTRODUCCION
El aumento en la presión arterial (PA) asociado con el envejecimiento predispone a las grandes arterias a una mayor rigidez arterial, lo que produce cambios en la matriz extracelular de la pared arterial y también hipertrofia patológica (7). El aumento en la tensión mecánica promovido por la elevada PA es uno de los determinantes principales de la rigidez de la pared arterial (10,17,26). El aumento en la rigidez arterial provoca hipertensión arterial sistémica (SAH) lo que acelera el proceso de envejecimiento vascular (8). Por otro lado, el ejercicio regular ayuda a prevenir la rigidez arterial y, por consiguiente, al igual que un tratamiento no farmacológico, ayuda a retardar el proceso de envejecimiento vascular. De hecho, los estudios demuestran que períodos cortos de entrenamiento o incluso series agudas de ejercicio pueden reducir la PA (17) y la rigidez arterial (25,26). Sin embargo, la respuesta hemodinámica al ejercicio (29) varía de una persona a otra. Esto sugiere que los efectos de ejercicio pueden ser mediados parcialmente por las variaciones genéticas. El estudio de los «genes candidatos» a ciertas respuestas fenotípicas es una de las estrategias utilizadas para verificar las posibles asociaciones entre las variantes genéticas y el efecto del ejercicio (1,18). Los estudios mencionados previamente han investigado los genes del sistema angiotensina-renina-aldosterona (ARAS), el cual desempeñaría un papel importante en la regulación de la PA. Uno de los intermediarios del ARAS es la enzima de conversión de angiotensina (ACE). Esta enzima presenta una influencia fisiológica importante en la homeostasis de la PA. El gen que codifica para la ACE, está localizado en el cromosoma 16 del genoma humano y es considerado un polimorfismo. La literatura científica lo ha distinguido por la inserción (I) o deleción (D) de 287 pares de bases en la secuencia de ADN, categorizando a los individuos así como homocigotos para la deleción (genotipo D/D), homocigotos para la inserción (genotipo I/I) y heterocigotos (genotipo I/D) (22). La conformación de los diferentes genotipos produce distintos niveles séricos de ACE, así el genotipo D/D tiene una concentración de ACE que casi duplica la concentración en el genotipo I/I y en el genotipo I/D (9,11,22). Aunque existe cierta controversia, la mayoría de la bibliografía demuestra una asociación entre el genotipo D/D y los factores de riesgo cardiovascular (2,13). Si bien los individuos responden de manera diferente al ejercicio, lo que puede ser explicado por las variantes genéticas, los estudios indican que las personas de edad avanzada de ambos sexos que realizan ejercicios de manera regular presentan niveles mas bajos de rigidez arterial o incluso carecen de la rigidez asociada al envejecimiento en comparación con sus pares sedentarios. En otros términos, la aptitud aeróbica está inversamente asociada con la rigidez arterial (24,26). Además, los estudios longitudinales han confirmado los efectos beneficiosos del ejercicio regular sobre la rigidez arterial en donde períodos relativamente cortos de entrenamiento aeróbico (por ejemplo, 2 a 6 meses) han demostrado una mejora en la adaptabilidad arterial en individuos de diferentes edades (5,12,27). Por consiguiente, nosotros supusimos que los polimorfismos de gen de ACE y los efectos agudos de ejercicio aeróbico pueden influir en la rigidez arterial en los individuos de edad avanzada. Además, ningún estudio ha investigado la influencia del polimorfismo de gen ACE y del ejercicio aeróbico agudo sobre la rigidez arterial en mujeres de edad avanzada. El objetivo de este estudio fue determinar la influencia del polimorfismo de inserción/deleción del gen de la enzima ACE y ejercicio aeróbico agudo en mujeres de edad avanzada, utilizando el índice ambulatorio de rigidez arterial (AASI).
METODOS
Sujetos
El estudio se realizó en el Laboratorio de Entrenamiento y Evaluación Física y de la Universidad Católica de Brasilia. Fue aprobado por el comité de ética local (nº63/2008). Veinticinco mujeres de edad avanzada (70,9 ± 6,1 años; 25,2 ± 2,7 kg/m2), que previamente habían sido estudiadas genéticamente para el polimorfismo I/D del gen ACE, contestaron una encuesta de salud y luego, firmaron un consentimiento informado, en el cual expresaban su acuerdo para participar en el estudio.
Procedimientos
Las participantes realizaron una prueba incremental para identificar el umbral anaeróbico (AT). Además realizaron dos sesiones: una sesión a 90% del AT y una sesión control. Ambas sesiones fueron realizadas en el mismo momento del día y en orden aleatorio.
Test Incremental (IT)
El IT se realizó en una bicicleta ergométrica (Lode, Modelo Excalibur, Países Bajos) con una carga de trabajo inicial de 15 Watts, seguida por incrementos de 15 watts en cada etapa de 3 min hasta el agotamiento volitivo. Todos los sujetos mantuvieron 60 revoluciones por minuto. Durante los últimos 20 seg de cada etapa incremental, se extrajo una muestra de 25µL de sangre capilar del lóbulo de la oreja mediante tubos capilares de vidrio heparinizados y calibrados, y se las depositó en microtubos (Eppendorf) que contenían 50µL de fluoruro de sodio (NaF) 1% para el posterior análisis de las concentraciones de lactato sanguíneo a través de un método electroenzimático (Yellow Springs 2,700 STAT, OH, EE.UU.). Además, se realizó un análisis de gases para determinar los parámetros ventilatorios (Cortex Biophysik model Metalyzer 3B, Germany). También se determinaron el índice de esfuerzo percibido (RPE) (escala de Borg con valores de 6 a 20) y frecuencia cardíaca (HR) (Electro Oy Polar, S-810 Model, Finland) hasta el agotamiento volitivo de las participantes.
Determinación del Umbral Anaeróbico (AT)
Los gases espirados fueron recolectados respiración por respiración y para realizar el análisis se utilizaron los datos de los últimos 20 seg. El umbral ventilatorio se determinó a través del análisis de los equivalentes ventilarorios de O2 (VE/VO2) y CO2 (VE/VCO2). El umbral fue considerado la intensidad que correspondió al momento en que VE/VO2 presentaba un aumento desproporcionado respecto a VE/VCO2 (25). La cinética del lactato sanguíneo durante las etapas IT señaló el umbral del lactato, considerado como una intensidad del ejercicio por encima de la cual se observaba un aumento desproporcionado en comparación con el aumento en la carga de trabajo (29). El AT fue calculado mediante el promedio de la intensidad encontrada tanto en el umbral ventilatorio como en el umbral del lactato.
Sesión en el 90% del Umbral Anaeróbico (90%AT)
La sesión 90%AT se realizó en una bicicleta ergométrica (Lode, model Excalibur, Netherlands) durante 20 min a una intensidad que correspondió a 90%AT, que fue previamente determinada en el test incremental (IT).
Sesión Control (CONT)
La sesión CONT se realizó según los mismos procedimientos usados en la sesión 90%AT, pero sin realizar el ejercicio. Los voluntarios permanecieron sentados cómodamente durante20 min.
Índice Ambulatorio de Rigidez Arterial (AASI)
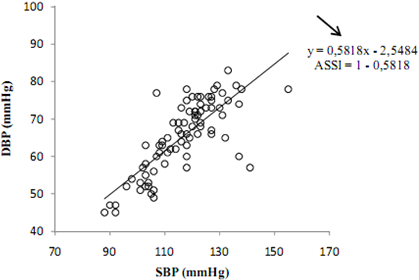
El AASI se calculó como la diferencia entre 1 y la pendiente de regresión de DBP (presión sanguínea diastólica) versus SPB (presión sanguínea sistólica) durante las 24 hrs en que se monitoreo la presión arterial (28) (Figura 1). Los valores deseables para AASI son <0,50 para las personas jóvenes y <0,70 para las personas de edad avanzada (28).
REFERENCIAS
1. Augeri AL, Tsongalis GJ, Van Heest JL, Maresh CM, Thompson PD, Pescatello LS (2009). The endothelial nitric oxide synthase −786 T>C polymorphism and the exercise-induced blood pressure and nitric oxide responses among men with elevated blood pressure. Atherosclerosis 204:e28–34
2. Bauters C, Amouyel P (1998). Association between the ACE genotype and coronary artery disease. Insights from studies on restenosis, vasomotion and thrombosis. Eur Heart J 19 (SupplJ):J24-9
3. Benetos A, Gautier S, Ricard S, Topouchian J, Asmar R, Poirier O, et al (1996). Influence of Angiotensin-Converting Enzyme and Angiotensin II Type 1 Receptor Gene Polymorphisms on Aortic Stiffness in Normotensive and Hypertensive patients. Circulation 94:698-703.
4. Bonithon-Kopp C, Ducimetiere P, Touboul PJ, Feve JM, Billaud E, Courbon C, Heraud V (1994). Plasma angiotensin-converting enzyme activity and carotid wall thickening. Circulation 89:952-954
5. Cameron JD, Dart MD (1994). Exercise training increase total systemic arterial compliance in humans. Am J Physiol 266:H693-701
6. Castellano M, Mulesan ML, Rizzoni D, Beschi M, Pasini G, Cinelli A, Salvetti M, Porteri E, Bettoni G, Kreutz R, Lindpaintner K, Agabiti Rosei E (1995). Angiotensin-converting enzyme I/D polymorphism and arterial wall thickness in general population: the Vobarno study. Circulation 91:2721-2724
7. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo Jr JL, Jones DW, Materson BJ, Oparil S, Wright Jr JT, Roccella EJ (2003). The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. The JNC 7 Report. JAMA 289:2560–2572
8. Cunha RS, Benetos A, Laurent S et al (1995). Distension capacity of the carotid artery and ambulatory blood pressure monitoring. Effects of age and hypertension. Am J Hypertens 8:343-352
9. Danser AHJ, Schalekamp MADH, Bax WA, Maassen van den Brink A, Saxena PR, Riegger GAJ, et al (1995). Angiotensin-converting enzyme in human heart. Circulation 92:1387-1388
10. Dzau VJ, Safar ME (1988). Large conduit arteries in hypertension: role of the renin-angiotensin system. Circulation 77:947-953.
11. Jalil JE, Córdova S, Ocaranza M, Schumacher E, Braun S, Chamorro G, Fardella C, Lavandero S (2002). Angiotensin I-converting enzyme insertion/deletion polymorphism and adrenergic response to exercise in hypertensive patients. Med Sci Monit 8:566-571
12. Kakiyama T, Sugawa J, Murakami H, Maeda S, Kuno S, Matsuda M (2005). Effects of short-term endurance training on aortic distensibility in young males. Med Sci Sports Exerc 37: 267-71
13. Kim K (2009). Association of angiotensin-converting enzyme insertion/deletion polymorphism with obesity, cardiovascular risk factors and exercise-mediated changes in Korean women. Eur J Appl Physiol 105:879-887
14. Lima L, Assis G, Hiyane W, Almeida W, Arsa G, Baldissera V, et al (2008). Hypotensive effects of exercise performed around anaerobic threshold in type 2 diabetic patients. Diabetes Res Clin Pract 81:216–222
15. Marre M, Jeunemaitre X, Gallois Y, et al (1997). Contribution of genetic polymorphism in the renin–angiotensin system to the development of renal complications in insulin-dependent diabetes: Genetique de la Nephropathie Diabetique (GENEDIAB) study group. J Clin Invest 99:1585–1595
16. Moraes CF, Souza ER, Souza VC, Medeiros EF, Gonçalves TF, Toledo JO, Karnikowski M, Gomes L, Karnikowski MG, Córdova C, Nóbrega OT (2008). A common polymorphism in the renin angiotensin system is associated with differential outcome of antihypertensive pharmacotherapy prescribed to Brazilian older women. Clin Chim Acta 396:70-75
17. Morais PK, Campbell CS, Sales MM, Motta DF, Moreira SR, Cunha VN, Benford RE, Simoes HG (2011). Acute resistance exercise is more effective than aerobic for 24 h blood pressure Control in individuals with type 2 diabetes. Diabetes Metab 37(2);112-117
18. Motta D, Lima L, Arsa G, Russo P, Sales MM, Moreira S, Morais P, Almeida W, Araujo R, Moraes M, Pesquero J, Simões H, Campbell C (2010). Effect of type 2 diabetes on plasma kallikrein activity after physical exercise and its relationship to post-exercise hypotension. Diabetes Metab 36:363-368
19. Pescatello LS, Turner D, Rodriguez N, Blanchard BE, Tsongalis GJ, Maresh CM, Duffy V, Thompson PD (2007). Dietary calcium intake and Renin Angiotensin System polymorphisms alter the blood pressure response to aerobic exercise: a randomized control design. Nutrition & Metabolism 4(1):1-10
20. Rao SP, Collins HL, DiCarlo SE (2002). Postexercise α-adrenergic receptor hyporesponsiveness in hypertensive rats is due to nitric oxide. Am J Physiol Regul Integr Comp Physiol 282:R960–R968
21. Rigat B, Hubert C, Alhenc-Gelas F, Cambien F, Corvol P, Soubrier F (1990). An insertion/deletion polymorphism in the angiotensin I-converting enzyme gene accounting for half the variance of serum enzyme levels. J Clin Invest 86:1343-1346
22. Sayed-Tabatabaei FA, Oostra BA, Isaacs A, van Duijn CM, Witteman JCM (2006). ACE polymorphisms. Circ Res 98:1123-1133
23. Svedahl K, MacIntosh B (2002). Anaerobic threshold: The concept and methods of measurement. Can J Appl Physiol 28:299-323
24. Tanaka H, DeSouza CA, Seals DR (1998). Absence of age-related increase in central arterial stiffness in physically active women. Arterioscler Thromb Vasc Biol 18:127-132
25. Tanaka H, Dinenno FA, Monahan KD, Clevenger CM, DeSouza CA, Seals DR (2000). Aging, Habitual exercise, and dynamic arterial compliance. Circulation 102:1270-1275
26. Vaitkevicious PV, Fleg JL, Engel JH, O’Connor FC, Wrigth JG, Lakatta LE, et al (1993). Effects of age and aerobic capacity on arterial stiffness in healthy adults. Circulation 88:1456-1462
27. Wasserman K, Mcilroy M (1964). Detecting the threshold of anaerobic metabolism in cardiac patients during exercise. Am J Cardiol 14:844-852.
28. Yan Li, Ji-Guang Wang, Eamon Dolan, Ping-Jin Gao, Hui-Feng Guo, Tim Nawrot, et al (2006). Ambulatory Arterial Stiffness Index Derived From 24-Hour Ambulatory Blood Pressure Monitoring. Hypertension 47:359-364
29. Zhang B, Sakai T, Miura S, et al (2002). Association of angiotensin-convertingenzyme gene polymorphism with the depressor response to mild exercise therapy in patients with mild to moderate essential hypertension. Clin Genet 62:328-33
Tratamiento con testosterona combinado con ejercicio para mejorar la fuerza muscular, la función física y la calidad de vida en hombres afectados por miositis por cuerpos de inclusión: un ensayo cruzado, aleatorizado, doble ciego y controlado con placebo
Resumen Introducción La miositis por cuerpos de inclusión (MCI) es la enfermedad del músculo...
Curso de recuperación de la fuerza de los músculos respiratorios y sus asociaciones con la capacidad de ejercicio y la fuerza de prensión manual: un estudio de cohorte prospectivo entre sobrevivientes de enfermedades críticas
Resumen Fondo La ventilación mecánica afecta los músculos respiratorios, pero se sabe poco sobre...
Las ganancias de fuerza muscular por semana son mayores en la parte inferior del cuerpo que en la parte superior del cuerpo en mujeres jóvenes sanas experimentadas con entrenamiento de resistencia: una revisión sistemática con metanálisis
Resumen Fondo Las mujeres están subrepresentadas en los estudios relacionados con el ejercicio de...
El ejercicio en casa mejora la calidad de vida de los supervivientes de cáncer de mama y próstata: un metanálisis
Resumen Fondo El cáncer de mama (BCa) y de próstata (PCa) son dos de los cánceres más comunes pero...

Efectos agudos de los calentamientos de FIFA11+ y Football+ sobre el rendimiento motor. Un ensayo controlado aleatorio cruzado
Resumen Introducción Pocos estudios que incluyan resultados contradictorios han abordado los...
