Resumen
La extensión de la hipertrofia del músculo esquelético en respuesta al entrenamiento de resistencia es muy variable en los humanos. El objetivo principal de este estudio fue explicar la naturaleza de esta variabilidad. Más específicamente, nos centramos en la población miogénica de células madre, la célula satélite (SC) como un mediador potencial de la hipertrofia. Veintitrés hombres (de 18 a 35 años) participaron en 16 semanas de entrenamiento progresivo de resistencia de cuerpo entero, lo que resulta en cambios de 7.9 ± 1.6% (rango de −1.9–24.7%) y 21.0 ± 4.0% (rango de −7.0 a 51.7%) en el volumen cuádricops y el área transversal miofibre (CSA), respectivamente. La respuesta SC a un solo episodio de ejercicio de resistencia (80% 1RM), analizado a través de tinción inmunofluorescente dio como resultado una expansión de la fibra tipo II asociada a SC 72 h después del ejercicio (pre: 11.3 ± 0.9; 72 h: 14.8 ± 1.4 SC/fibra tipo II; P <0.05). El entrenamiento dio como resultado una expansión de la piscina SC asociada con Tipo I (PRE: 10.7 ± 1.1; Post: 12.1 ± 1.2 SC/Fibra Tipo I; P <0.05) y Fibras Tipo II (PRE: 11.3 ± 0.9; Post: 13.0 ± 1.2 SC/Fibra Tipo II; P <0.05). El análisis de las respuestas de SC individuales reveló una correlación entre el cambio relativo en el tipo I asociado con SC 24 a 72 horas después de un episodio agudo de ejercicio de resistencia y el aumento porcentual de la masa del tejido delgado cuádriceps evaluados por MRI (R (R2= 0.566, p = 0.012) y el cambio relativo en el SC asociado al tipo II después de 16 semanas de entrenamiento de resistencia y el aumento porcentual de la masa del tejido delgado de los cuádriceps evaluados por MRI (R2= 0.493, p = 0.027). Nuestros resultados sugieren que la respuesta SC al ejercicio de resistencia está relacionada con el alcance de la hipertrofia muscular inducida por el entrenamiento.
Introducción
Existe un alto grado de variación interindividual en la hipertrofia del músculo esquelético después del entrenamiento del ejercicio de resistencia a pesar de la exposición al ejercicio de la misma intensidad relativa (1), (2). La respuesta de los individuos a los estímulos hipertróficos como el ejercicio de resistencia conduce a una respuesta muy variable con respecto a la acumulación de tejido magro (1). La base de la variabilidad en las respuestas hipertróficas a la capacitación es poco conocida; Sin embargo, factores como la variación genética (3)polimorfismos genéticos (4), (5)perfiles transcriptómicos (6) La capacidad de activar proteínas de señalización específicas que se sabe que son importantes en la síntesis de proteínas musculares (7)y expresión de microARN (8) han sido identificados como posibles puntos de control en la regulación de la respuesta hipertrófica.
El músculo esquelético posee una población funcional de células madre residentes comúnmente denominadas células satelitales (SC) (9). Los SC se activan, proliferan y fusionan dando lugar a miotubos nacientes o fusibles a las fibras musculares existentes en respuesta a varios estresores, como la carga mecánica o la lesión. (10). La progresión de SC desde la activación, la proliferación hasta la diferenciación terminal se rige por una red de factores de transcripción denominados factores reguladores miogénicos (MRF) (11)–(13). Aunque el papel esencial que juega SC en el mantenimiento de la función saludable del músculo esquelético es ampliamente aceptado su papel en la mediación de la hipertrofia del músculo esquelético inducido por el ejercicio es discutible. Varios hallazgos de los estudios de la hipertrofia inducida por el entrenamiento del ejercicio de resistencia en humanos destacan la asociación de SC con hipertrofia muscular (2), (14). Sin embargo, en base a los resultados de los modelos de roedores, otros proponen que SC se presente en la mediación de la hipertrofia muscular (15), (16). Sin embargo, proponemos que debido a que la hipertrofia puede ocurrir en los modelos de roedores compensados por SC no necesariamente hace que su contribución sea sin importancia al contribuir a la hipertrofia en humanos en condiciones fisiológicas. En cambio, los modelos de agotamiento selectivo de SC que demuestran hipertrofia, en condiciones de sobrecarga extrema, simplemente establecen la capacidad de los mecanismos redundantes para compensar y provocar hipertrofia.
En humanos, un creciente cuerpo de evidencia ha caracterizado la respuesta de SC al ejercicio de resistencia e implicó un papel para la adición nuclear durante la adaptación de la fibra muscular (9), (17)–(21). Sin embargo, solo un estudio anterior en humanos ha intentado correlacionar la variabilidad en la respuesta miogénica al ejercicio de resistencia aguda o después del entrenamiento de resistencia (2), (14).
La miostatina (MSTN, o factor de diferenciación de crecimiento 8, GDF-8), un miembro de la familia de factor de crecimiento transformador (TGF-β), es un regulador negativo del crecimiento muscular (22). Los nocauts de MSTN en múltiples especies (incluido un estudio de caso humano) dieron como resultado una hipertrofia muscular bruta y un aumento general en la masa corporal de 2 a 3 veces en comparación con las contrapartes de tipo salvaje (22). Es importante destacar que parece haber un papel conservado para MSTN en humanos, lo que demostramos al mostrar una reducción aguda en la co-localización de MSTN a SC en el músculo esquelético humano. in vivo Después de un solo ejercicio. Además, se descubrió que el envejecimiento estaba asociado con una capacidad deteriorada para disminuir la proporción de SC conjocalizado con MSTN después del ejercicio (9). Colectivamente, estos resultados implican un papel para MSTN en la regulación de la función SC humana y sugieren que MSTN puede regular la hipertrofia (23).
El propósito de esta investigación fue determinar si la respuesta aguda SC a un episodio de ejercicio de resistencia o la expansión de la piscina SC se relacionó con la hipertrofia muscular después del entrenamiento. Presumimos que las personas con una respuesta SC aguda elevada, basada en la expansión del grupo de SC y la progresión de SC a través del programa miogénico, también demostrarían el mayor aumento en la masa del tejido magro.
Métodos
Sujetos
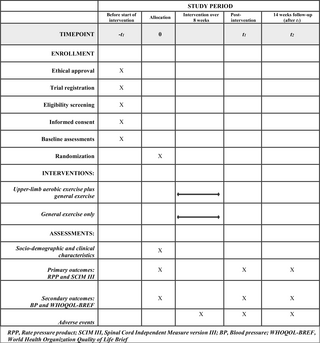
Veintitrés machos sanos previamente no entrenados (de 18 a 35 años) completaron 16 semanas de entrenamiento de resistencia de todo el cuerpo. Los participantes fueron recreativos activos, pero no tenían experiencia formal de entrenamiento con pesas en el último año. Este estudio fue aprobado por la Junta de Ética de Investigación de la Universidad de McMaster y se adhirió a los principios expresados en la Declaración de Helsinki. El consentimiento informado por escrito se obtuvo de todos los participantes antes del comienzo del estudio. Las características completas del tema se han publicado previamente (24).
Entrenamiento con ejercicio
El programa de capacitación se ha descrito anteriormente en otro lugar (24). En resumen, sin embargo, el entrenamiento consistió en cuatro sesiones supervisadas por semana, divididas en dos sesiones de cuerpo superior y dos. Las sesiones de la parte superior del cuerpo consistieron en prensa de cofre, prensa de hombro, latir hacia abajo, fila, rizo de bíceps y ejercicio de extensión de tríceps. Las sesiones del cuerpo inferior consistían en prensa de piernas, extensión de la pierna, rizo de piernas, prensa de pantorrilla y ejercicio abdominal. El entrenamiento progresó de dos conjuntos realizados al 70% del máximo de repetición de 1 (RM) a cuatro conjuntos realizados al 85% de 1RM, con todos los conjuntos realizados hasta el punto de agotamiento muscular momentáneo. Al concluir cada entrenamiento, los participantes consumieron una bebida que contenía 30 g de proteína de suero, 25,9 g de carbohidratos y 3.4 g de grasa (Musashi P30, Notting Hill Victoria, Australia).
Protocolo de ejercicio agudo
Antes del inicio del programa de capacitación de resistencia, los sujetos completaron una intensidad de ejercicio de resistencia de intensidad (80% 1RM). El ejercicio agudo consistió en cuatro conjuntos y ocho repeticiones cada una de prensa de piernas, extensión de las piernas, prensa de terneros y rizo de piernas. El set final se realizó a la falla volitiva. Todos los ejercicios (con la excepción de la prensa de piernas) se realizaron utilizando equipos de ejercicio tipo entrenamiento de circuito Hur (Hur, Kokkola Finlandia).
Imágenes de resonancia magnética y absorptiometría de rayos X de doble energía
Los escaneos de resonancia magnética (MRI) de los cuádriceps fueron completadas por todos los participantes antes y después del programa de capacitación. Antes de escanear, los participantes descansaron en la posición supina durante 1 h para evitar la influencia del cambio de líquido en el volumen muscular. La imagen se realizó en un escáner 3T HD (SIGNA MRI System, GE Medical, Milwaukee, WI). La adquisición de imágenes en el plano axial se realizó con los siguientes parámetros: tiempo de repetición/tiempo de eco = 2100 ms/23.58 ms; campo de visión = 28 cm; Tamaño de la matriz = 320/320 reconstruido a 512/512 fase/frecuencia; espesor de la rebanada = 5 mm. La adquisición de imágenes del muslo utilizó una bobina de torso de ocho canales con dos excitaciones. Había un espacio de 10 mm entre rodajas. El volumen de cuádriceps se midió desde la primera rebanada donde el recto femoral era visible hasta el primer corte donde se veía el glúteo maximus y se calculó multiplicando el área de corte por la distancia entre las cortes. El área de cada corte se determinó con el software Image J (Institutos Nacionales de Salud de los Estados Unidos, Bethesda, Maryland, EE. UU.). Hora del día, el ángulo de la junta y la compresión de la pierna se combinaron en todas las exploraciones previas y posteriores al entrenamiento.
La composición corporal se evaluó mediante escaneo de rayos X de doble energía de cuerpo entero (QDR-4500A, Versión de software 12.31; Hologic, Bedford, MA). Los sujetos fueron ayunados y no habían completado ningún ejercicio antes del escaneo. Todos los escaneos fueron realizados y analizados por un técnico capacitado. Todos los escaneos se completaron de acuerdo con el protocolo de AIS Body Dexa (24), (25). Antes de la medición, el DEXA se calibró según las pautas de fabricación. Todos los sujetos estaban alineados centralmente antes del escaneo, las manos y los pies se aseguraron para consistencia.
Recolección de muestras
Se obtuvieron biopsias musculares de la Vastus lateral Antes, 24 hy 72 h después de un combate agudo de ejercicio antes de (pre-1, 24-1, 72-1) y siguiendo (pre-2, 24-2, 72-2) 16 semanas de entrenamiento de ejercicios utilizando una aguja Bergström modificada de 5 mM con succión manual bajo anestesia local (2% xilocaína). Los sujetos no habían participado en ninguna actividad física al menos 96 horas antes de la recolección de la biopsia de referencia (pre). Tras la escisión, las muestras de músculos se diseccionaron inmediatamente en piezas que se congelaron en nitrógeno líquido (análisis de expresión génica), se embebieron en un compuesto óptimo de temperatura de corte (OCT) para el análisis de inmunofluorescencia, o mantenido como tejido fresco en medios de crecimiento (análisis de flujo de flujo de medio de flujo.
Citometría de flujo
Aproximadamente 65 mg de músculo obtenido de biopsias antes del entrenamiento (pre-1, 24-1, 72-1) se prepararon para el análisis de citometría de flujo. Brevemente, las muestras musculares se pesaron antes del mantillo con tijeras quirúrgicas estériles en placas de cultivo de tejidos de 35 mm. Las suspensiones de células individuales se lograron usando digestión enzimática. 400 µl de solución de colagenasa/dispase (10 mg/ml de colagenasa B, Diagnóstico de Roche, Mannheim, Alemania; 2,4 U/ml de dispase, tecnologías de vida, Garlsbad, CA, EE. UU.2) se agregó a cada placa, se trituró durante ∼2 min y se incubó a 37 ° C durante 9 minutos, este paso se repitió con un tiempo de incubación de 5 min. Luego, la muestra se filtró usando un filtro de malla de 70 µM y se centrifugó a 800 g durante 5 minutos para obtener una pellet de células mononucleares. Las células se fijaron en etanol helado al 70% y se almacenaron a -20 ° C. Las muestras se prepararon como se describió anteriormente (26) Mediante la incubación en el anticuerpo primario de Pax7 (Banco de Hibridoma de Estudios de Desarrollo, Iowa City, IA, EE. UU.), Anticuerpo secundario anti-ratón de cabra Alexa Fluor 488 de cabra (1∶500, Invitrogen, Carlsbad, CA, EE. UU.) Y yoduro de propidio. El análisis de citometría de flujo se completó en un instrumento Beckman-Coulter Epics XL (Beckman-Coulter Inc., Brea, CA, EE. UU.) Operado por un técnico capacitado.
Inmunofluorescencia
Las criosecciones musculares, de 7 µm de espesor, se prepararon a partir de muestras incrustadas de OCT, se dejaron secar al aire durante 15-45 minutos y se almacenaron a -80 ° C. Tissue sections were fixed in 4% paraformaldehyde (PFA) for 10 min, washed 3×5 min in PBST, blocked for 60 min at RT (in PBS containing 2% bovine serum albumin, 5% FBS, 0.2% Triton x-100, 0.1% NaAzide, and 2% goat serum), and subsequently incubated in primary antibodies Pax7 (neat, DSHB), Laminin (1∶250 o 1∶750, Abcam, Cambridge, MA, EE. UU.), MHCI (ordenado, DSHB, Iowa City, IA, EE. UU.), MHCII (1∶1000, Abcam, Cambride, MA, EE. UU.) Y Myostatin (1∶150, Millipore, …