Resumen
La interleucina-6 de citocina (IL-6) es un regulador esencial del crecimiento del músculo hipertrófico mediado por células satelitales a través del transductor de señal de factor de transcripción y el activador de la transcripción 3 (STAT3). No se ha investigado la importancia de esta vía vinculada a la modulación de la expresión de factores reguladores miogénicos en el músculo esquelético de rata que experimenta hipertrofia después del ejercicio de resistencia. En este estudio, la fosforilación y la localización nuclear de STAT3, junto con la expresión génica sensible a IL-6/STAT3, se midieron después de un solo ejercicio de resistencia y 10 semanas de entrenamiento. Se obtuvieron muestras de músculo profundus de Flexor Digitorum de ratas Wistar 2 y 6 horas después de un solo episodio de ejercicio de resistencia y 72 h después del último episodio de 2, 4 o 10 semanas de entrenamiento de resistencia. Observamos un aumento en los ARNm de IL-6 y SOCS3 concomitantes con la fosforilación de STAT1 y STAT3 después de 2 y 6 horas de un solo episodio de ejercicio (P <0.05). Los genes de respuesta temprana dependientes de STAT3, como CYCLIND1 y CMYC, también estaban regulados al alza, mientras que los ARNm de MYOD y MYF5 se regularon negativamente (P <0.05). Las células satelitales positivas para BRDU aumentaron a las 2 y 6 horas después del ejercicio (P <0.05). La hipertrofia de fibra muscular alcanzó hasta el 100% después de 10 semanas de entrenamiento y la expresión de ARNm de MyF5, C-Myc y Cyclin-D1 disminuyeron, mientras que el ARNm de IL-6 permaneció regulado al alza. Llegamos a la conclusión de que la vía de señalización IL-6/STAT1/STAT3 y sus genes receptivos después de un solo ejercicio de resistencia son un evento importante que regula el grupo de SC y el comportamiento involucrado en la hipertrofia muscular después de diez semanas de entrenamiento en el músculo esquelético de ratas.
Introducción
El entrenamiento de fuerza humana es bien conocido por aumentar la masa del músculo esquelético e inducir cambios fenotípicos musculares (1). El aumento de la fuerza muscular resultante de la hipertrofia del músculo esquelético es de gran interés para las personas, incluidos los atletas de poder de élite, los pacientes que rehabilitan la atrofia inducida por la enfermedad y los ancianos que han disminuido la movilidad debido a la debilidad muscular. La hipertrofia muscular es inducida por mecanismos celulares y moleculares, incluidas una serie de vías de señalización que conducen a un aumento en la síntesis de proteínas y una disminución en la descomposición de proteínas.
Las células satelitales del músculo esquelético (SC) son un grupo de células inactivas ubicadas entre la lámina basal y la membrana plasmática de las miofibras en los músculos maduros (2). Estas células son principales responsables del crecimiento muscular postnatal por hipertrofia (3), (4) así como para la regeneración muscular inducida por ejercicio o lesión (5). De hecho, el entrenamiento de resistencia/fuerza puede aumentar la actividad de SC y/o el número de myonuclei (6), (7). Aunque los SC son reguladores clave del crecimiento muscular durante el desarrollo y la adaptación muscular después del ejercicio (8)–(10)la regulación celular de la función SC permanece en gran medida inexplorada.
Recientemente, la interleucina-6 (IL-6) se ha implicado como parte de la activación de los SC humanos en respuesta a las contracciones excéntricas dañinas (11), (12). Tradicionalmente, IL-6 se considera una citocina proinflamatoria pleiotrópica asociada con el control y la coordinación de las respuestas inmunes (13). La evidencia creciente indica que las células del músculo esquelético son una fuente importante adicional de IL-6 después de un solo episodio de ejercicio de resistencia en humanos o hipertrofia inducida por sobrecarga en roedores (14)–(16)al menos en parte bajo la dependencia del factor responsable del suero (SRF) (17). Curiosamente, IL-6 Knock-Out (IL-6–/–) Los ratones demostraron una respuesta hipertrófica roma y una acumulación myonuclear relacionada con SC más baja en comparación con los ratones de tipo salvaje después de la hipertrofia compensatoria (18). Además, SC de IL-6–/– Los ratones demostraron una capacidad proliferativa deteriorada, tanto in vivo como in vitro. Este deterioro se relacionó con la falta de activación mediada por IL-6 del transductor de señal y el activador de la señalización de la transcripción-3 (STAT3). La activación de Janus tirosina quinasas (JAKS) por IL-6 conduce a la fosforilación de STAT3 (PSTAT3) y la activación que provoca la dimerización y la translocación de PSTAT3 al núcleo (19)–(21). pstat3 induce la transcripción de genes posteriores involucrados en varias funciones biológicas (22) incluida la proliferación celular, la diferenciación y la supervivencia de los mioblastos. Estas respuestas están mediadas por la expresión de los reguladores del ciclo celular c-myc y Cyclind1 (23), (24)los genes antiapoptóticos BCL-2 y Bcl-xl (25)–(27) y genes de respuesta temprana intermedia como c-fos y banebón (28)así como el factor angiogénico (VEGF) (29) y el supresor de la señalización de citocinas 3 (SOCS3) (19). Además, yang et al. (2009) informaron que STAT3 podría interactuar con Myod, el complejo STAT3-Myod es responsable del efecto estimulante de STAT3 sobre la diferenciación miogénica (30).
Durante la recuperación del ejercicio, la activación de la señalización de STAT3 se ha demostrado en el músculo esquelético humano (20), (31). Sin embargo, pocos estudios han explorado el vínculo entre la vía IL-6/JAK/STAT y el comportamiento de SC en la hipertrofia muscular inducida por el entrenamiento de fuerza o resistencia tanto en animales como en humanos. Por ejemplo, si la respuesta muscular IL-6 aún persiste después de varias semanas de entrenamiento aún no se ha investigado. Además, los mecanismos precisos de la vía IL-6/JAK/STAT en el comportamiento de las células satelitales a través de la regulación de los factores reguladores miogénicos conocidos deben definirse en la hipertrofia del músculo esquelético inducido por el entrenamiento de resistencia. Para ese propósito, modificamos un modelo de ejercicio fisiológico de Lee et al. (2004) (32) Investigar los eventos moleculares y celulares subyacentes relacionados con la vía IL-6/JAK/STAT3 de la rata Forearm Musc Muscle Flexor Digitorum Profundus (FDP) después de un solo combate de ejercicio o después de 2, 4 y 10 semanas de entrenamiento de resistencia voluntaria. Presumimos que 10 semanas de entrenamiento de resistencia intenso conducirían a una hipertrofia vinculada a la estimulación génica dependiente del músculo repetido IL-6/STAT3, particularmente aquellos genes relacionados con el comportamiento de las células satelitales, después de cada ejercicio de resistencia. (33).
Materiales y métodos
Declaración de ética
Este estudio fue aprobado por el Comité de Ética de los Experimentos de Animales del Languedoc Roussillon de acuerdo con las pautas del Consejo de Investigación Nacional Francesa para el cuidado y el uso de animales de laboratorio. (Número de permiso: CEEA-LR-1069). Toda la cirugía se realizó bajo anestesia pentobarbital de sodio, y todos los esfuerzos se hicieron para minimizar el sufrimiento.
Animales
Se compraron 48 ratas Wistar Han masculinas, que pesaban alrededor de 220 g, se compraron en Charles River (Charles River Laboratories International, Wilmington, MA) y se alojaron a una temperatura ambiente constante y humedad y se mantuvieron a un ciclo de luz-oscuridad de 12:12 h. Las ratas tenían acceso a la comida de rata estándar y al agua ad libitum.
Diseño experimental
Las ratas se ejercieron en aparatos adaptados de Lee et al. (2004) (32). Se realizó una escalera de 1 m con pasos de cuadrícula de 2 cm e inclinada a 85 ° en nuestro laboratorio. Inicialmente, las ratas se familiarizaron con la escalera al practicar la escalada voluntaria de la escalera desde la parte superior hasta la jaula superior durante una semana, después de lo cual comenzó el régimen de entrenamiento de fuerza o ejercicio. Las bolsas de tela que contenían pesos se unieron a la base de la cola con una correa de velcro.
Protocolo de entrenamiento de resistencia.
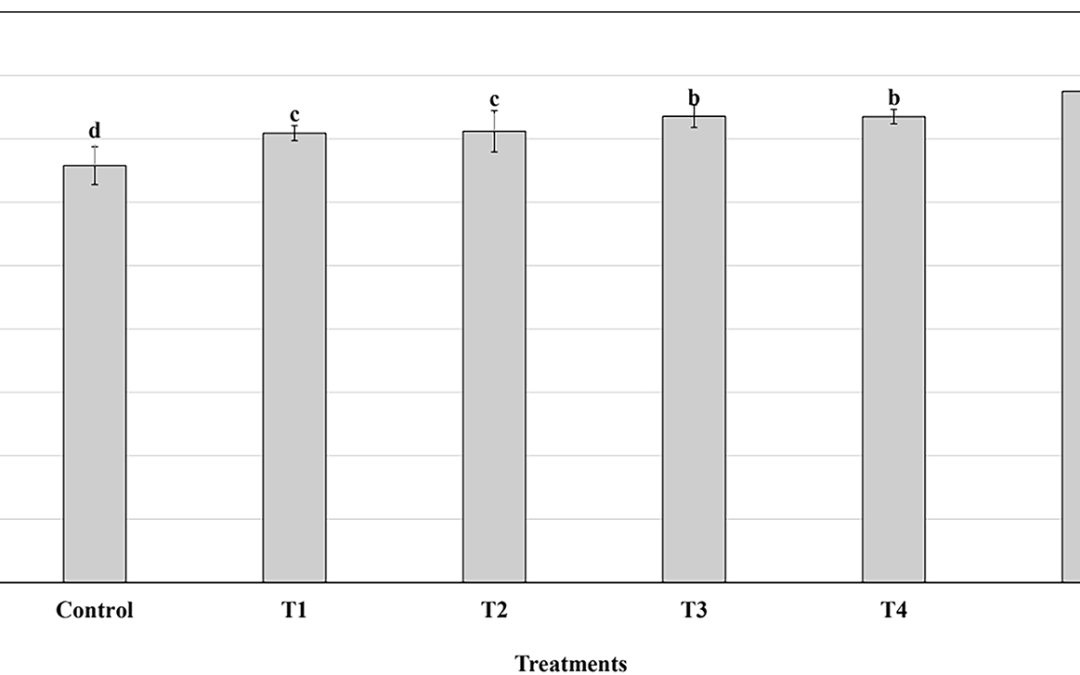
Después de una semana de adaptación, 36 ratas se dividieron aleatoriamente en seis grupos: CTL2, CTL4, CTL10 (CTL = controles sin entrenamiento, n = 6 en cada grupo) y TR2, TR4 y TR10, que fueron ratas entrenadas durante 2, 4 y 10 semanas (resistencia al entrenamiento n = 6 en cada grupo). El peso inicial unido a la cola de cada animal fue del 50% de su peso corporal (BW). Las ratas se colocaron en la parte inferior del aparato de escalada y cuando llegaron a la parte superior de la escalera, se les permitió descansar en una jaula doméstica simulada durante 2 minutos. Las ratas realizaron 10 repeticiones o subidas, cinco veces por semana durante 2 (TR2), 4 (TR4) o 10 (TR10) semanas. El entrenamiento se realizó todas las tardes. Las cargas aumentaron en un 10% cada 2 días, pero solo si la rata pudo realizar 10 subidas por conjunto. Después de 2 semanas de entrenamiento, la carga alcanzó el 120% de BW, 150% después de 4 semanas y 210% después de 10 semanas de entrenamiento. La repetición máxima se determinó como el peso máximo que llevaba la escalera de ejercicios por las ratas en una subida y solo se midió el último día después de 10 semanas de entrenamiento. 72 horas después de la última pelea de entrenamiento, las ratas fueron asesinadas a través de una inyección intraperitoneal de Pentobarbital 50 mg.kg−1 (Penthotal®). El músculo del antebrazo, Flexor Digitorum Profundus (FDP), se diseccionó, se congeló en isopentano enfriado en nitrógeno líquido y se almacenó a -80 ° C para su uso posterior.
Protocolo de ejercicio de resistencia única.
Después de una semana de adaptación, las ratas se dividieron aleatoriamente en tres grupos: REST (n = 4) con ratas sacrificadas justo antes del ejercicio, E2H (n = 4) y E6H (n = 4) donde las ratas se sacrificaron 2 y 6 horas después del único episodio de ejercicio respectivamente. Veinticuatro horas antes del sacrificio, los animales de cada grupo se inyectaron por vía intraperitoneal con 100 mg.kg−1 de bromodeoxiuridina (Brdu, B5002, Sigma Aldrich, St Louis, MO) para identificar células en proliferación. Por la tarde, las ratas de los grupos E2H y E6H hicieron 4 subidas con una carga que alcanzó el 25% de BW, 4 subidas al 50%, 4 subidas al 75% y 6 subidas al 100% de BW. Entre cada subida, las ratas se permitieron descansar durante 2 minutos. Las ratas se anestesiaron mediante una inyección intraperitoneal de Pentobarbital 50 mg.kg−1 (Penthotal®). Los músculos FDP del antebrazo se cosecharon, se congelaron en isopentano enfriado en nitrógeno líquido y almacenados a -80 ° C para su uso posterior. Los animales fueron asesinados por una sobredosis de pentobarbital.
Inmunohistoquímica de la cadena pesada de miosina
Para el análisis del tipo de fibra, se obtuvieron secciones seriales transversales de los músculos FDP (10 µm de espesor) usando un criostato a -20 ° C. Las secciones congeladas se fijaron con solución de acetona durante 10 minutos, se lavaron y se incubaron 30 minutos en solución de bloqueo de solución salina tamponada con fosfato (PBS) con albúmina de suero bovino al 2% (BSA). Las secciones se incubaron 2 horas a temperatura ambiente con anticuerpo monoclonal de ratón (DSHB, Iowa City, Iowa) dirigidos contra MHC-I (#A4-971), MHC IIA (#2F7), MHC IIX (#6H1) y MHC-IIB (#10F5). Las secciones se lavaron tres veces con PBS y se incubaron una hora a 37 ° C con anticuerpo secundario IgG anti-ratón de conejo conjugado con peroxidasa (A-9044, Sigma-Aldrich, St Louis, MO). La tinción de MHC se reveló con Novared ™ (Vector® Lab, Burlingame, CA) y toboganes montados con Mowiol. Las imágenes fueron capturadas con un microscopio (Zeiss Axiophot) junto con una cámara CCD conectada a una computadora. El análisis MHC se realizó con el software Image-J®. El área transversal de la fibra muscular (CSA) se obtuvo en imágenes de aumento × 10 de 1500 fibras por grupo (250 fibras por músculo de 6 ratas).
Transferencia Western
Se homogeneizaron las muestras de FDP de 20 mg en 10 volúmenes de tampón de lisis (tris 20 mM pH 6,8, NaCl 100 mM, EGTA 1 mM, NAF 100 mM, Triton X-100 0,5%, Na3VO4 5 mm) con cócteles inhibitorios de proteasa (P8340, Sigma Aldrich, St Louis, MO). El homogeneizado se rotó 10 minutos a 4 ° C y el sobrenadante recogido. Las muestras de proteínas (50 µg) se desnaturalizaron y se separaron en SDS-PAGE al 10%. The proteins were transferred onto a nitrocellulose membrane and blocked in 5% wt/vol BSA for phosphoSTAT1 (Tyr 701), phosphoSTAT3 (Tyr 705), phosphoErk1/2 (Tyr 202/204) and 5% wt/vol dry milk for STAT1, STAT3, Erk1/2 and α-tubulin antibodies in Tris-buffered saline with 0.1% Vol/Vol Tween 20 (TBST) durante una hora a temperatura ambiente. Anticuerpos primarios PSTAT1 (1/1000), PSTAT3 (1/1000), PERK1/2 (1/1000), STAT1 (1/1000), STAT3 (1/1000), ERK1/2 (1/1000) y α-tubulina (1/2500) se dilataron en amortiguador de caída en el amortiguador y incubaron durante la noche a las 4 ° C. Posteriormente, las membranas se lavaron tres veces con TBST y se incubaron una hora a temperatura ambiente con un anticuerpo secundario conjugado con peroxidasa de rábano picante, Donkey Anti-conejo IgG (1/4000) para PSTAT1, PSTAT3, ERK1/2, STAT1 y STAT3 y …